达州市渠县境内含有丰富的深层地下食盐资源 食盐是日常生活中的必需品 也是重要的化工原料。(1)经测定
| 达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。 (1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下: 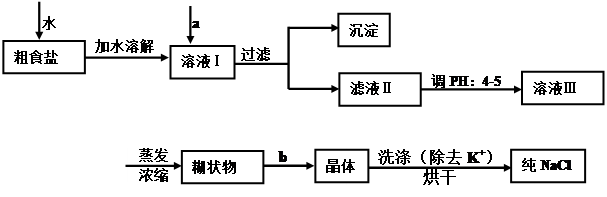 所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。 ①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为 (只填化学式),b步操作的名称是 。 ②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是 ,用PH试纸测定滤液ⅡPH值的方法是 。 (2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要 (填仪器名称),应称取NaCl g (3)下列操作会导致所配NaCl溶液浓度偏高的是
|
参考解答
| (14分)(每空2分)(1)①BaCl2、NaOH、Na2CO3 冷却结晶② 75%乙醇 用玻璃棒蘸取少许滤液Ⅱ滴在pH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定滤液Ⅱ的酸碱度,(2)500ml容量瓶、胶头滴管 73.1g (3)CE |
试题分析:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+;浓溶液冷却结晶可得晶体,所以b步操作的名称是冷却结晶;②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中;用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许滤液Ⅱ滴在pH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定滤液Ⅱ的酸碱度;(2)溶液配制步骤为:一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、500ml容量瓶、胶头滴管,需要NaCl的质量为2.5mol?L-1×0.5L×58.5g/mol=73.1g,;(3)A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线,溶液的体积偏大,使所配溶液的浓度偏低,错误;B.未将洗涤烧杯内壁的溶液转入容量瓶,溶质的质量偏小,使使所配溶液的浓度偏低,错误;C.定容时,俯视刻度线,溶液的体积偏小,使所配溶液的浓度偏大,正确;D.转移溶液之前,容量瓶内有少量蒸馏水,对溶液的体积无影响,所配溶液的浓度不变,错误; E、称量时,天平指针指向左盘,溶质的质量偏大,使使所配溶液的浓度偏大,正确. |
相似问题
下列装置所示的实验中 能达到实验目的的是:
下列装置所示的实验中,能达到实验目的的是:
下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是选项待提纯的物质选用的试剂操作方法ANa
下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是选项待提纯的物质选用的试剂操作方法ANaOH(Na2CO3)盐酸-BCO2(CO)氧气加热CFe(Zn)F
下列方案能够达到实验目的的是 A.用浓溴水除去苯中的苯酚 B.用新制Cu(OH)2悬浊液鉴别苯 乙
下列方案能够达到实验目的的是A.用浓溴水除去苯中的苯酚 B.用新制Cu(OH)2悬浊液鉴别苯、乙醛、乙酸C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸D.将
下列实验中 所采取的分离方法与对应原理都正确的是选项目的分离方法原理A除去Fe(OH)3胶体中的Fe
下列实验中,所采取的分离方法与对应原理都正确的是选项目的分离方法原理A除去Fe(OH)3胶体中的FeCl3过滤分散质微粒的大小不同B除去纯碱中的碳酸氢铵加热
下列除杂的方法错误的是A.除去N2中的少量O2:通过灼热的Cu粉 收集气体B.除去SO2中的少量HC
下列除杂的方法错误的是A.除去N2中的少量O2:通过灼热的Cu粉,收集气体B.除去SO2中的少量HCl:通入饱和NaHSO3溶液,干燥后收集气体C.除去Fe2O3固体中












