某矿样含有大量的CuS 少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程 取该矿样
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。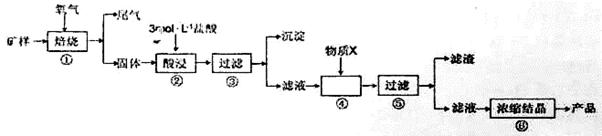 已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
回答下列问题: (1)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用右图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______、______ 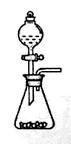 (2)培烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______、______ (3)步骤②酸浸过程中,需要用到3mol·L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________ (4)步骤④加入物质X的目的是_____,物质X可以选用下列物质中的_____。 A.氢氧化钠 B.稀盐酸 C.氨水 D.氧化铜 (5)当溶液中金属离子浓度低于1×10-5 mol·L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]= _____。 |
参考解答
(1)2H2O2 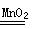 2H2O + O2 ↑,2Na2O2 + 2H2O =' 4NaOH' + O2 ↑。 2H2O + O2 ↑,2Na2O2 + 2H2O =' 4NaOH' + O2 ↑。 (2)2H2SO3+O2=2H2SO4,2(NH4)2SO3+O2=2(NH4)2SO4,2NH4HSO3+O2=2NH4HSO4 (3)100 mL容量瓶、量筒 (4)调控溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 ; D (5)1×10-15 |
试题分析:(1)该装置是固液不加热制气体的装置,可用该装置制备氧气的反应有H2O2和MnO2及Na2O2和H2O。 (2)尾气中含有SO2气体,通入氨水中后,SO2可与氨水反应生成(NH4)2SO3、NH4HSO3,SO32-易被氧化为SO42-。 (3)配制一定物质的量浓度盐酸溶液时,是将浓盐酸稀释为稀盐酸,因此还需要的玻璃仪器有容量瓶和量筒。 (4)步骤④加入X物质是为了调节溶液的pH,除去Fe3+。为防止引入杂质及Cu2+沉淀,应选用CuO。 (5)Fe2+完全沉淀时pH=9,则溶液中的c(OH-)=1×10-5mol·L-1,则Ksp=c(Fe2+)·c2(OH-)=1×10-5×(1×10-5)2=1×10-15。 |
相似问题
(10分)选择下列实验方法分离物质 将分离方法的序号填在横线上。A.萃取分液法B.加热分解C.结晶法
(10分)选择下列实验方法分离物质,将分离方法的序号填在横线上。A.萃取分液法B.加热分解C.结晶法D.分液法E.渗析法 F.蒸馏法 G.过滤法(1)_____
下列物质中可用来干燥NH3的是A.浓H2SO4B.碱石灰C.P2O5D.无水CaCl2
下列物质中可用来干燥NH3的是A.浓H2SO4B.碱石灰C.P2O5D.无水CaCl2
下列物质的提纯或离子检验的方法正确的是 A.用渗析的方法精制氢氧化铁胶体B.以精铜为阳极 粗铜
下列物质的提纯或离子检验的方法正确的是A.用渗析的方法精制氢氧化铁胶体B.以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜C.除去KCl溶液中的少量
香烟烟雾中含有CO CO2 SO2 H2O等气体 用① 无水CuSO4 ② 澄清石灰水
香烟烟雾中含有CO、CO2、SO2、H2O等气体,用① 无水CuSO4­② 澄清石灰水 ③红热CuO ④碱石灰 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液等药品可将其
氯仿(CHCl3)可以作为麻醉剂 常因保管不善被空气氧化 生成剧毒物质光气(COCl2):2CHCl
氯仿(CHCl3)可以作为麻醉剂,常因保管不善被空气氧化,生成剧毒物质光气(COCl2):2CHCl3+O2→2HCl+2COCl2,为防止出现医疗事故,使用前要检验其是否












