有等质量的镁和锌 前者放入质量分数为10%的稀盐酸中 后者放入质量分数为10%的稀硫酸中 产生氢气的
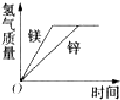
有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如右图所示.下列说法正确的是( )
 |
参考解答
| A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,而锌没有剩余.故A错误; B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确; C、根据图象可以得到,最终产生的氢气的质量相等,故C正确; D、由于锌的相对原子质量大,因此得到相同质量的氢气,参加反应的金属锌的质量要大一些,则消耗的镁与锌的质量 之比不等于1:1,故D错误; 故选BC. |
相似问题
实验室需用高锰酸钾制取3.2g氧气 写出反应的方程式并计算需高锰酸钾的质量是多少克?
实验室需用高锰酸钾制取3 2g氧气,写出反应的方程式并计算需高锰酸钾的质量是多少克?
小刚发现养鱼师傅为解决鱼塘中氧气不足的问题 向鱼塘中撒一种淡黄色固体 其主要成分是过氧化钙(CaO2
小刚发现养鱼师傅为解决鱼塘中氧气不足的问题,向鱼塘中撒一种淡黄色固体,其主要成分是过氧化钙(CaO2).他查阅资料得知:过氧化钙与水反应,生成氢氧
在含1.17g NaCl和0.84g NaF的溶液中 加入足量的AgNO3的溶液 产生2.87g沉淀
在含1 17gNaCl和0 84gNaF的溶液中,加入足量的AgNO3的溶液,产生2 87g沉淀.由此可判断( )A.AgF难溶于水B.全部NaCl参加反应C.全部NaF参加反应D.NaF和AgNO3不反应
实验室用13克锌与足量硫酸反应 可制得氢气多少克?
实验室用13克锌与足量硫酸反应,可制得氢气多少克?
100g稀硫酸恰好能跟50g 16%的氢氧化钠溶液完全中和 求:(1)稀硫酸中溶质的质量分数.(2)
100g稀硫酸恰好能跟50g16%的氢氧化钠溶液完全中和,求:(1)稀硫酸中溶质的质量分数.(2)反应后所得硫酸钠溶液中溶质的质量分数.












