小可同学为测定某铁合金的含铁量 做了如下实验 称取11.4克样品 放入质量为50.0克的烧杯中 再往
| 小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0克的烧杯中,再往烧杯中加入100.0克的稀盐酸(杂质不与酸反应、不溶于水)并对烧杯进行了四次称量,记录数据如下: |
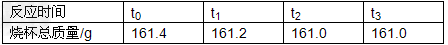 |
| 求: (1)反应产生的氢气的质量 (2)该铁合金中铁的质量分数(保留一位小数) |
参考解答
| (1)分析题干给出的数据以及表格的数据可知此反应进行完全,根据质量守恒定律,可得产生氢气的质量为:11.4g+100g+50g﹣161g=0.4g (2)设产生0.4g氢气需要铁的质量为x,则有 Fe+2HCl==FeCl2+H2↑ 56 2 x 0.4g 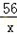 = =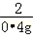 x=11.2g 所以铁的质量分数为: 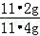 ×100%=98.2% ×100%=98.2%答:反应产生的氢气的质量为0.4g,该铁合金中铁的质量分数为98.2%. |
相似问题
在氧气性质和制取的实验中 需完成碳和铁丝在氧气中燃烧两实验 实验册提示取用高锰酸钾的质量为7克。计算
在氧气性质和制取的实验中,需完成碳和铁丝在氧气中燃烧两实验,实验册提示取用高锰酸钾的质量为7克。计算分析:小明实验时采用容积为125毫升的集气瓶,
如下图所示 试管中盛有无色液体A 气球中装有固体B 将气球中的固体B倒人液体A中 观察到有无色气泡产
如下图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体B倒人液体A中,观察到有无色气泡产生,且气球涨大.(1)若B是锌粉,则A中液体能使紫
将55g氯化钙溶液和72g碳酸钠溶液混合后 恰好完全反应。过滤后得到117g溶液。请计算:(1)反应
将55g氯化钙溶液和72g碳酸钠溶液混合后,恰好完全反应。过滤后得到117g溶液。请计算:(1)反应后生成沉淀的质量。(2)过滤后所得溶液中溶质的质量分数。
在天平的两个托盘上各放一个烧杯 杯中盛有等质量等质量分数的稀硫酸 此时天平平衡。如果一边放少许锌粒
在天平的两个托盘上各放一个烧杯,杯中盛有等质量等质量分数的稀硫酸,此时天平平衡。如果一边放少许锌粒,另一边放入相同质量的铁,两者完全溶解后,天
实验室用过氧化氢溶液在二氧化锰催化下制取氧气 现已制得氧气64 g 则消耗过氧化氢的质量为多少?
实验室用过氧化氢溶液在二氧化锰催化下制取氧气,现已制得氧气64 g,则消耗过氧化氢的质量为多少?












