Ⅰ.取3份73g某浓度的盐酸 分别加入盛有NaHCO3 和KHCO3组成的同一种混合物中 进行甲 乙
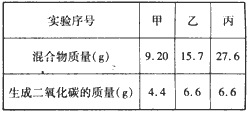
| Ⅰ.取3份73g某浓度的盐酸,分别加入盛有NaHCO3 和KHCO3组成的同一种混合物中,进行甲、乙、丙三组实验, 测得如下数据(不考虑CO2在水中的溶解)。 |
|
| 回答下列问题: (1)盐酸的溶质质量分数为____。 (2)混合物中NaHCO3和KHCO3的质量比为____。 Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题。 (1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成气体的量都为定值,则A 的可能组成是(可以不填满,也可补充) |
|
| (2)若A是MgCO3和CaCO3组成的混合物,取10.0g的A与足量的盐酸反应,产生气体的质量x范围是多少? |
参考解答
| I.(1)在甲组实验中盐酸没有完全反应,乙、丙组中盐酸完全反应,所以应选择乙或丙组CO2质量计算HCl的质量。 设73g盐酸中含HCI的质量为x。  ~ HCl ~ CO2 ~ HCl ~ CO2 36.5 44 x 6.6g 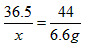 x=5. 475g x=5. 475g(2)设混合物中KHCO3的质量为x,NaHCO3的质量为y。 KHCO3 + HCl== KCl+H2O + CO2 ↑ 100g 44g x  NaHCO3+ HCl==NaCl + H2O + CO2 ↑ 84g 44g y  列方程式x +y =9. 2g,  解得 x=5g,y=4.2g。 则NaHCO3与KHCO3的质量比为4.2g:5g =21:25。 Ⅱ.(1)要使混合物组合发生反应生成CO2的量是定值,那么组分的相对分子质量应相同,组分中含 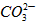 的质量分数也相同。 的质量分数也相同。NaHCO3和MgCO3,KHCO3和CaCO3两组符合上述条件。 (2)解:设10.0g的A中只含有MgCO3,它与足量盐酸反应产生的CO2的质量为a, 设10g A中只含有CaCO3,它与足量盐酸反应产生的CO2的质量为b。 MgCO3 +2HCl==MgCl2 + CO2 ↑ +H2O 84 44 10.0g a 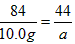 ,a=5. 24g。 ,a=5. 24g。 CaCO3 +2HCl==CaCl2 +CO2 ↑ +H2O 100 44 10.0g b 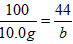 ,b=4. 40g。 ,b=4. 40g。所以,产生气体的质量x范围是4. 40g<x<<5.24g |
相似问题
某炼铁厂在高温条件下利用一氧化碳还原赤铁矿(主要成分是Fe2O3)。现有100t的赤铁矿 理论上可炼
某炼铁厂在高温条件下利用一氧化碳还原赤铁矿(主要成分是Fe2O3)。现有100t的赤铁矿,理论上可炼得纯铁56t。(反应的化学方程式:3CO+Fe2O32Fe+3CO2)计
利用下图所示装置测定某含菱铁矿的矿石样品中碳酸亚铁的质量分数(杂质不含铁元素且在实验过程中不发生任何
利用下图所示装置测定某含菱铁矿的矿石样品中碳酸亚铁的质量分数(杂质不含铁元素且在实验过程中不发生任何变化),实验数据记录在下表中。提示:FeCO3FeO+
某工厂每天产生浓度为0.49%的废H2SO4溶液1×106g 需要用碱溶液中和处理。试计算:(1)该
某工厂每天产生浓度为0 49%的废H2SO4溶液1×106g,需要用碱溶液中和处理。试计算:(1)该厂每天要处理的废酸液中含有H2SO4__________g。(2)若用烧碱处
我市某厂高温煅烧石灰石制生石灰 每天需要含碳酸钙80%的石灰石原料100t 假设杂质受热不分解。请
我市某厂高温煅烧石灰石制生石灰,每天需要含碳酸钙80%的石灰石原料100t ,假设杂质受热不分解。请计算:(1)理论上每天可生产氧化钙多少吨?(2)煅烧
小明购得用于食用菌种植的轻质碳酸钙 标签如下。为测定其含钙量小明进行的实验是:①称取样品5g;②加入
小明购得用于食用菌种植的轻质碳酸钙,标签如下。为测定其含钙量小明进行的实验是:①称取样品5g;②加入足量7 3%的盐酸充分反应,反应的化学方程式为: