根据下列元素电势图: 说明当pH=0时 分别在下列两种条件下:(1)KI过量;(2)KMnO4过量
根据下列元素电势图: 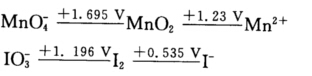 说明当pH=0时,分别在下列两种条件下:(1)KI过量;(2)KMnO4过量时,KMnO4与KI溶液将会发生哪些反应?为什么?写出有关反应方程式。
说明当pH=0时,分别在下列两种条件下:(1)KI过量;(2)KMnO4过量时,KMnO4与KI溶液将会发生哪些反应?为什么?写出有关反应方程式。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案: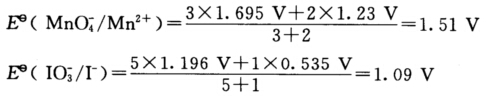 可见Eθ(MnO4-/Mn2+)>Eθ(IO3-/I-) (1)当KI过量时由于Eθ(IO3-/I-)>Eθ(I2/I-)MnO4-将首先氧化I-为I2因为MnO4-不够故不能将I-氧化为IO3-: 2MnO4-+10I-+16H+===2Mn2++5I2+8H2O (2)当KMnO4过量时先氧化I-为I2继而将I2氧化为IO3-: 2MnO4-+I2+4H+===2Mn2++2IO3-+2H2O 又因为Eθ(MnO4-/Mn2+)>Eθ(MnO2/Mn2+)则过量的MnO4-又可以将上述反应中生成的Mn2+再氧化为MnO2: 2MnO4-+3Mn2++2H2O===5MnO2↓+4H+
可见Eθ(MnO4-/Mn2+)>Eθ(IO3-/I-) (1)当KI过量时由于Eθ(IO3-/I-)>Eθ(I2/I-)MnO4-将首先氧化I-为I2因为MnO4-不够故不能将I-氧化为IO3-: 2MnO4-+10I-+16H+===2Mn2++5I2+8H2O (2)当KMnO4过量时先氧化I-为I2继而将I2氧化为IO3-: 2MnO4-+I2+4H+===2Mn2++2IO3-+2H2O 又因为Eθ(MnO4-/Mn2+)>Eθ(MnO2/Mn2+)则过量的MnO4-又可以将上述反应中生成的Mn2+再氧化为MnO2: 2MnO4-+3Mn2++2H2O===5MnO2↓+4H+
可见Eθ(MnO4-/Mn2+)>Eθ(IO3-/I-)(1)当KI过量时,由于Eθ(IO3-/I-)>Eθ(I2/I-),MnO4-将首先氧化I-为I2,因为MnO4-不够,故不能将I-氧化为IO3-:2MnO4-+10I-+16H+===2Mn2++5I2+8H2O(2)当KMnO4过量时,先氧化I-为I2,继而将I2氧化为IO3-:2MnO4-+I2+4H+===2Mn2++2IO3-+2H2O又因为Eθ(MnO4-/Mn2+)>Eθ(MnO2/Mn2+)则过量的MnO4-又可以将上述反应中生成的Mn2+再氧化为MnO2:2MnO4-+3Mn2++2H2O===5MnO2↓+4H+
相似问题
欲制备Fe2+的标准溶液 应选择的最合适的试剂是 ( )A.FeCl2溶于水B.硫酸亚铁铵溶于水C.
欲制备Fe2+的标准溶液,应选择的最合适的试剂是 ( )A.FeCl2溶于水B.硫酸亚铁铵溶于水C.FeCl3溶液中加铁屑D.铁屑溶于稀酸请帮忙给出正确答案和分析,谢谢!
Fe3O4与盐酸作用的产物为 ( )A.FeCl3+H2OB.FeCl2+H2OC.FeCl3+Fe
Fe3O4与盐酸作用的产物为 ( )A.FeCl3+H2OB.FeCl2+H2OC.FeCl3+FeCl2+H2OD.FeCl3+Cl2请帮忙给出正确答案和分析,谢谢!
锆和铪分属第4族第二和第三过渡系的元素 但它们的原子半径却近似相等。如何用镧系收缩解释这种现象?请帮
锆和铪分属第4族第二和第三过渡系的元素,但它们的原子半径却近似相等。如何用镧系收缩解释这种现象?请帮忙给出正确答案和分析,谢谢!
下列新制出的沉淀在空气中放置 颜色不发生变化的是 ( )A.Mg(OH)2B.Fe(OH)2C.Co
下列新制出的沉淀在空气中放置,颜色不发生变化的是 ( )A.Mg(OH)2B.Fe(OH)2C.Co(OH)2D.Ni(OH)2请帮忙给出正确答案和分析,谢谢!
用来检验Fe3+离子的试剂为 ( )A.KIB.NH4SCNC.NaOHD.NH3.H2O请帮忙给出
用来检验Fe3+离子的试剂为 ( )A.KIB.NH4SCNC.NaOHD.NH3 H2O请帮忙给出正确答案和分析,谢谢!












