某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.(一)原料岩盐水主要含氯化钠 此外还含有较
| 某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品. (一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
(2)10℃时由100g水配制得到的饱和硫酸钠溶液中溶质的质量是______g,溶质的质量分数是______(精确到0.1%). (二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下: 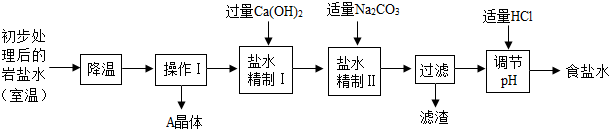 (3)“降温”的目的是析出副产品“A晶体”,A的化学式是______. (4)“操作I”中的操作是______,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有______. (5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是______. (6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是______. | ||||||||||||||||||||||||||||||||
参考解答
(1)如图 (2)由于在10℃时,硫酸钠的溶解度是9.6g,即在100克水中最多溶解9.6g硫酸钠,形成的饱和溶液中溶质的质量分数为:
(3)由于岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁,而且氯化钠的溶解度受温度的影响很小,而硫酸钠的溶解度随温度的降低明显减小,因此降温时析出的主要是Na2SO4,故答案为:Na2SO4 (4)由于是把析出的晶体和溶液分开,因此应用过滤的方法,故答案为:过滤,漏斗 (5)由于氢氧化钙溶液能够和岩盐水中的氯化镁反应生成氢氧化镁沉淀,故答案为:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓ (6)由于碳酸钠和氯化钙反应生成碳酸钙沉淀,碳酸钠和剩余的氢氧化钙也会反应.故答案为:CaCl2+Na2CO3═CaCO3↓+2NaCl和Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
相似问题
以下是KCl部分溶解度数据 下列说法中正确的是( )温度/℃0204060溶解度/g27.634.
以下是KCl部分溶解度数据,下列说法中正确的是( )温度 ℃0204060溶解度 g27 634 040 045 5A.KCl饱和溶液中不能再溶解其他物质B.20℃时,100g饱和K
10℃时 硝酸钠的溶解度是80克 10℃时将20克硝酸钠溶解在60克水中 应再加入______克硝酸
10℃时,硝酸钠的溶解度是80克,10℃时将20克硝酸钠溶解在60克水中,应再加入______克硝酸钠才能配成饱和溶液.
下列说法中正确的是( )A.100g水中最多能溶解某物质40g 则该物质的溶解度为40gB.4℃时
下列说法中正确的是( )A.100g水中最多能溶解某物质40g,则该物质的溶解度为40gB.4℃时,溶质N的饱和溶液120g中含N20g,所以4℃时,溶质N的溶解度
如图为A B两物质的溶解度曲线 其中错误的说法是( )A.20°C时 A的溶解度<B的溶解度B.3
如图为A、B两物质的溶解度曲线,其中错误的说法是( )A.20°C时,A的溶解度<B的溶解度B.30°C时,A、B的溶解度为40C.在30°C时280克A的饱和溶液
20℃时 把m克某物质溶于水 制得V毫升 密度为P克/厘米3的饱和溶液 则20℃时该物质的溶解度为_
20℃时,把m克某物质溶于水,制得V毫升,密度为P克 厘米3的饱和溶液,则20℃时该物质的溶解度为______.












