甲 乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰 经混合后装入
| 甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04 g,将它继续加热,直到氯酸钾全部分解,得到氧气672 mL(标准状况)。求甲实验时氯酸钾分解的百分率。 |
参考解答
| 50% |
| 从题给已知条件可知,解题时应从乙得到的氧气的量入手。 设乙分解KClO3的质量为x,甲分解KClO3的质量为y。 2KClO3 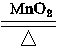 2KCl + 3O2↑ 2KCl + 3O2↑2 mol×122.5 2 mol×74.5 3 mol×22.4 g·mol-1 g·mol-1 L·mol-1 x 0.672 L 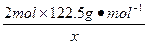 = =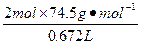 解得:x='2.45' g 在4.04 g混合物中:m(KCl)='4.04' g-0.10 g-2.45 g='1.49' g。即甲分解KClO3时得到的KCl质量为1.49 g,由此可计算y: 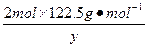 = =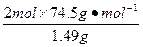 解得:y='2.45' g。 故甲实验时KClO3分解的百分率为: 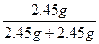 ×100%=50%。 ×100%=50%。本题若从物质的量入手计算会更简便。 解:设乙分解KClO3的物质的量为x,甲分解KClO3的物质的量为y。 2KClO3 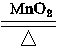 2KCl + 3O2↑ 2KCl + 3O2↑2 mol 2 mol 3 mol X 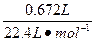 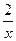 = = , 解得:x='0.02' mol , 解得:x='0.02' mol在4.04 g混合物中:m(KCl)='4.04' g-0.10 g-(0.02 mol×122.5 g·mol-1)='1.49' g。即甲分解KClO3得到的KCl的质量为1.49 g,由此计算y: 2KClO3 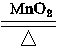 2KCl+3O2↑ 2KCl+3O2↑2 mol 2 mol y 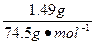 解得:y='0.02' mol 故甲实验时KClO3分解的百分率为: 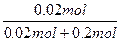 ×100%=50%。 ×100%=50%。 |
相似问题
某温度下 将Cl2通人NaOH溶液中 反应得到NaCl NaClO NaClO3的混合液 经测定c(
某温度下,将Cl2通人NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定c(Cl―)与c(ClO)之比为6:1,则Cl2与NaOH溶液反应时,被氧化的氯气的体积分
某些化学反应可用下式表示 A + B ─→ C + D + H2O请回答下列
某些化学反应可用下式表示 A + B─→ C + D + H2O请回答下列问题:(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程
(10分)为讲授“氯气的性质和用途” 某老师利用二氧化锰和浓盐酸为主要原料 设计一套如图所示的实验装
(10分)为讲授“氯气的性质和用途”,某老师利用二氧化锰和浓盐酸为主要原料,设计一套如图所示的实验装置(其中A是连有注射器针头的橡皮管,针头已插入
(1)在标准状况下 有下列物质①4gH2 ②33.6LCH4 ③1molH2O ④3.01×102
(1)在标准状况下,有下列物质①4gH2,②33 6LCH4, ③1molH2O,④3 01×1023个O2。其中含分子数最多的是(填序号,下同) ,质量最大的是
下列溶液中加入氯化钡溶液生成白色沉淀 在加入稀硝酸震荡 白色沉淀不消失的是A.Na2SiO3B.Na
下列溶液中加入氯化钡溶液生成白色沉淀,在加入稀硝酸震荡,白色沉淀不消失的是A.Na2SiO3B.Na2CO3C.Na2SO3D.Na3PO4












