用化学方法测定微量碘化物时 必须利用“化学放大”反应将碘的量“放大” 然后再进行测定。下面是“化学放
| 用化学方法测定微量碘化物时,必须利用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是“化学放大”反应的实验步骤: ①向含微量I-并且呈中性或弱酸性溶液里加入溴水,将I-完全氧化成 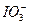 ,煮沸去掉过量的Br2; ,煮沸去掉过量的Br2;②向由①制得的水溶液中加入过量的酸性KI溶液,振荡使反应进行完全; ③在②得到的水溶液中加入足量的CCl4,振荡,把生成的I2从水溶液里全部转移到CCl4中,用分液漏斗分液去掉水层; ④向③得到的CCl4层加入肼(即联氨H2N—NH2)的水溶液,振荡,使I2完全以I-形式从CCl4层进入水层,用分液漏斗分液去掉CCl4层。 经过以上四步得到的水溶液里,含有通过反应而“放大”了的碘,请回答下列问题: (1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:_______________________。  (2)将右图所示的分液漏斗中的下层液体放出的操作步骤为: ①___________________________________________。 ②旋开活塞,使下层液体流出到一个烧杯里,当下层液体全部流出活塞的细孔时,__________________。 ③从漏斗上口倒出上层液体。 ④旋开活塞,将留在颈部的下层液体放出到盛接下层液体的烧杯里。 (3)若忽略实验过程中出现的损失,经过一次“化学放大”的溶液里,I-的量是原溶液里I-的量的____________倍。经过n次“化学放大”的溶液里,I-的量是原溶液里的量的________倍。 |
参考解答
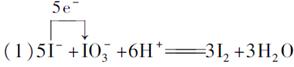 (2)①取下漏斗口上的塞子 ②迅速关闭活塞 (3)6 6n |
考查氧化还原和萃取分液的实验操作。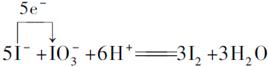 ,经过该反应得到的I2又和H2N—NH2发生氧化还原反应生成I-,这样得到的I-是原来的6倍,所以经过n次“化学放大”的溶液里,I-的量是原溶液里的量的6n倍。 ,经过该反应得到的I2又和H2N—NH2发生氧化还原反应生成I-,这样得到的I-是原来的6倍,所以经过n次“化学放大”的溶液里,I-的量是原溶液里的量的6n倍。 |
相似问题
实验室用含4 mol HCl的浓盐酸与足量MnO2共热制取氯气 若生成的气体全部逸出 在标准状况下可
实验室用含4 mol HCl的浓盐酸与足量MnO2共热制取氯气,若生成的气体全部逸出,在标准状况下可收集气体的体积是( )A.44 8 LB.22 4 LC.小于22 4 LD.介于22 4 L于44 8 L之间
根据氯元素在下列物质中的化合价 判断下列说法中错误的是( )A.Cl2既具有氧化性又具有还原性
根据氯元素在下列物质中的化合价,判断下列说法中错误的是( )A.Cl2既具有氧化性又具有还原性B.Cl-具有还原性C.只具有氧化性D.ClO-只具有氧化性
关于新制的氯水和久置的氯水 下列说法不正确的是( )A.新制的氯水呈黄绿色 久置的氯水无色B.
关于新制的氯水和久置的氯水,下列说法不正确的是( )A.新制的氯水呈黄绿色,久置的氯水无色B.新制的氯水漂白作用强,久置的氯水漂白作用很弱或消失C.
下列操作中加入(或通入)试剂至过量 最后无沉淀生成的是A.将CO2通入饱和Na2CO3溶液中B.将C
下列操作中加入(或通入)试剂至过量,最后无沉淀生成的是A.将CO2通入饱和Na2CO3溶液中B.将CO2通入Na2SiO3溶液中C.将SO2通入Ba(NO3)2溶液中D.将CO2
下列关于氯化氢的性质叙述 不正确的是( )A.氯化氢极易溶于水B.氯化氢比溴化氢稳定C.氯化氢
下列关于氯化氢的性质叙述,不正确的是( )A.氯化氢极易溶于水B.氯化氢比溴化氢稳定C.氯化氢是电解质D.液态氯化氢就是盐酸












