将由CaCO3 MgCO3组成的混合物充分加热至质量不再减少时 称得残留物的质量为原混合物的一半 则
| 将由CaCO3、MgCO3组成的混合物充分加热至质量不再减少时,称得残留物的质量为原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是多少? |
参考解答
| Ca、Mg两元素原子的物质的量之比为1:3. |
| 将CaCO3、MgCO3混合物加热时,发生反应: CaCO3 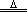 CaO+CO2↑ MgCO3 CaO+CO2↑ MgCO3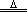 MgO+CO2↑ MgO+CO2↑则有:n(CaCO3)=n(CaO) n(MgCO3)=n(MgO) 100 g·mol-1×n(CaO)+84 g·mol-1×n(MgO)=2×[56 g·mol-1×n(CaO)+40 g·mol-1×n(MgO)] n(CaO):n(MgO)=1:3,所以N(Ca):N(Mg)=1:3. |
相似问题
变色眼镜的玻璃镜片内含有少量溴化银和微量氧化铜.当玻璃受到阳光照射时 因为发生_________反应
变色眼镜的玻璃镜片内含有少量溴化银和微量氧化铜.当玻璃受到阳光照射时,因为发生_________反应(用化学方程式表示,下同),而使玻璃由无色变成灰黑色
下列说法错误的是( )A.钠和铁一样 都能在氯气中燃烧生成金属氯化物B.液氯是氯气的水溶液 它能使
下列说法错误的是( )A.钠和铁一样,都能在氯气中燃烧生成金属氯化物B.液氯是氯气的水溶液,它能使干燥的有色布条褪色C.氯气跟变价金属反应生成高
下列实验现象的描述错误的是( )A.CuSO4溶液不能产生丁达尔现象 Fe(OH)3胶体能产生丁达
下列实验现象的描述错误的是( )A.CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象B.向石蕊试液中加入新制氯水,石蕊试液变红后一直
(1)有一瓶被漂白过的品红试液 甲同学认为是被Cl2漂白 乙同学则认为是被SO2漂白了 请用简单的实
(1)有一瓶被漂白过的品红试液,甲同学认为是被Cl2漂白,乙同学则认为是被SO2漂白了,请用简单的实验方法判断出到底哪位同学的猜测是真的______.(2)2
(1)理论上需要参加反应的二氧化锰多少克?(2)被氧化的HCl的质量为多少克?
(1)理论上需要参加反应的二氧化锰多少克?(2)被氧化的HCl的质量为多少克?












