常温下 在溶液中可发生以下反应:①16H++10Z-+2XO4-==2X2++5Z2 +8H2O ②
| 常温下,在溶液中可发生以下反应: ①16H++10Z-+2XO4-==2X2++5Z2 +8H2O, ②2M2++R2==2M3++2R-, ③2R-+Z2==R2+2Z-, 由此判断下列说法错误的是 |
| [ ] |
A.氧化性强弱顺序为: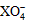 <Z2 <R2 <M3+ <Z2 <R2 <M3+ B.还原性强弱顺序为:X2+ <Z- <R- <M2+ C.Z元素在反应①中被氧化,在③中被还原 D.常温下可发生反应2M2++Z2==2M3++2Z- |
参考解答
| A |
相似问题
已知在某温度时可发生如下三个反应:①C+CO2=2CO ②C+H2O=CO+H2 ③CO+H2O=C
已知在某温度时可发生如下三个反应:①C+CO2=2CO ②C+H2O=CO+H2 ③CO+H2O=CO2+H2由此可判断,在该温度下C、CO、H2的还原性由强到弱的顺序正确的是 [
向含有Cu(NO3)2 Zn(NO3)2 Fe(NO3)3 AgNO3各0.1 mol的混合溶液中加
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下
已知下列5个方程式 则MnO2 KMnO4 H2SO4(浓) H3PO4 Br2五种物质氧化能力强弱
已知下列5个方程式,则MnO2、KMnO4、H2SO4(浓)、H3PO4、Br2五种物质氧化能力强弱正确的排列顺序是[ ]①H2SO4(浓)+2HBrSO2↑+Br2↑+2H2O②2KMnO4+16HCl
已知:① A+ B2+ = A2++B ② D +2H2O = D(OH)2 + H2↑ ③ 以B
已知:① A+ B2+ = A2++B ,② D +2H2O = D(OH)2+ H2↑,③ 以B 、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E ,B-2e-=B2+
R X Y和Z是四种元素 其常见化合价均为+2价 且X2+与单质R不反应;X2++Z=X+Z2+;Y
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符












