(12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2 从而消除污染。该反应中涉及的微
(12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。  该反应过程中,被氧化与被还原的元素的物质的量之比为 。 (2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。 (3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。 已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol 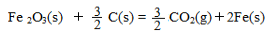 △H = +230 kJ/mol △H = +230 kJ/molC(s)+O2(g) = CO2(g) △H = -390 kJ/mol 铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。 a.氧化还原 b.复分解 c.置换 |
参考解答
| (1)NO3- + Al +H2O→ Al(OH)3 + N2 + OH-(2分) 5∶3 (2)O2+4e-+2H2O=4OH- 1.5 (3)2 Al(s) + Fe2O3 (s)= 2 Fe(s) +Al2O3 (s) △H = - 600 kJ/mol a c |
试题分析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。 (2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;Al元素由0价升高为+3价,则 Al~3e ̄,所以消耗13.5 g Al时转移电子:13.5g÷27g/mol×3=1.5mol。 (3)首先写出化学方程式并注明各物质的状态,然后根据盖斯定律求出?H,?H='1/2' ?H1+?H2 – 3/2 ?H3=- 600 kJ?mol ̄1,可写成热化学方程式;铝热反应发生了化合价的变化,为氧化还原反应,反应物为一种单质和一种化合物,生成了一种新的单质和一种新的化合物,也属于置换反应,故a、c选项正确。 |
相似问题
下列离子方程式书写正确的是A.Cu(OH)2中加入硫酸:OH- + H+ = H2OB.Al2(SO
下列离子方程式书写正确的是A.Cu(OH)2中加入硫酸:OH- + H+ = H2OB.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3+ + 3SO42-+ 3Ba2+ + 6OH
下列表示对应化学反应的离子方程式正确的是 ( )。A.碳酸钠的水解:CO32—+2H2
下列表示对应化学反应的离子方程式正确的是 ( )。A.碳酸钠的水解:CO32—+2H2OH2CO3+2OH-B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+
下列反应中属于氧化还原反应的离子方程式的是 A.CaCO3+2H+=Ca2++CO2↑+H2OB.2
下列反应中属于氧化还原反应的离子方程式的是 A.CaCO3+2H+=Ca2++CO2↑+H2OB.2Fe2++Cl2=2Fe3++2Cl-C.HCO3-+H+=CO2+H2OD.Na2O+H2O=2Na++2OH-
下列离子方程式书写正确的是 ( )A.向氧化铁中加入氢碘酸:Fe2O3+6H++2I-=2F
下列离子方程式书写正确的是()A.向氧化铁中加入氢碘酸:Fe2O3+6H++2I-=2Fe2++I2+3H2OB.Cu片插入FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+C.向Al
某溶液与Al反应能放出H2 下列离子在该溶液中一定能大量共存的是
某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是












