已知HCO3―+AlO2― +H2O=CO32― +Al(OH)3↓;将足量的KHCO3溶液不断滴入
已知HCO3―+AlO2― +H2O=CO32― +Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为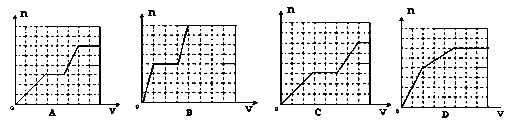 |
参考解答
| B |
试题分析:HCO3-先与OH-反应,再与AlO2-反应,而HCO3-与OH-反应生成CO32-后,Ba2+与CO32-生成沉淀,HCO3-+OH-+Ba2+═BaCO3↓+H2O①,消耗1molHCO3-、1molOH-、1molBa2+,生成1molBaCO3沉淀,此阶段化学方程式为KHCO3+Ba(OH)2═BaCO3↓+H2O+KOH;HCO3-+OH-═CO32-+H2O②,消耗2mol HCO3-、2molOH-(OH-消耗完),没有沉淀生成.此阶段化学方程式为KHCO3+KOH=K2CO3+H2O(此时KOH有2mol,原溶液中有1mol,反应①产生1mol);HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓③,消耗1molHCO3-、1mol AlO2-(AlO2-消耗完),生成1molAl(OH)3沉淀.此阶段化学方程式为KHCO3+KAlO2+H2O═Al(OH)3↓+K2CO3.三阶段消耗KHCO3的物质的量为1:2:1,也即KHCO3溶液体积比为1:2:1;一、三阶段对应的生成沉淀的物质的量为1:1,第二阶段不生成沉淀,所以图象B符合,答案选B。 |
相似问题
下列反应属于氧化还原反应的是 [ ]A.3NaOH + FeCl3═Fe(OH)3↓+ 3
下列反应属于氧化还原反应的是 [ ]A.3NaOH + FeCl3═Fe(OH)3↓+ 3NaCl B.HCl + NaHCO3==NaCl+H2O+CO2↑ C.Cu + 4HNO3(浓) ==Cu(NO3)2 + 2NO2↑+ 2H2OD.CuCl2+2NaOH==Cu(OH)2↓+2NaCl
下列离子方程式书写正确的是A.在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2=HCl
下列离子方程式书写正确的是A.在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2=HClO+HSO3-B.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+ =2Fe3+ +3H
下列叙述或表示方法正确的是( )A.Na2O2是离子化合物 其阴 阳离子个数比为1∶1B.N(NO
下列叙述或表示方法正确的是()A.Na2O2是离子化合物,其阴、阳离子个数比为1∶1B.N(NO2)3()既有氧化性又有还原性C.NH4HCO3溶液与过量的NaOH溶液微热
下列反应的离子方程式正确的是( )A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=A
下列反应的离子方程式正确的是( )A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+B.向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe
下列离子方程式中 正确的是 A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+
下列离子方程式中,正确的是A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑B.碳酸钠溶液显碱性:CO32—+H2OHCO3—+OH—C.氯气通入冷水












