(1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O n=______ R元素在R
| (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=______,R元素在RO3n-中的化合价是______. (2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如: ①在上述有编号的步骤中,需用氧化剂的是______(填编号). ②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题: ______Na2Cr2O7+______KI+______HCl--______CrCl3+_NaCl+______KCl+______I2+  (用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是______. 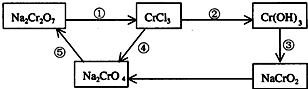 |
参考解答
| (1)根据电荷守恒可得n=1,RO3-中氧元素的化合价是-2价,根据化合价规则,所以R的化合价是+5, 故答案为:1;+5; (2)①合价升高元素在反应中被氧化,需加入氧化剂才能实现,在各步转化中,只有④是化合价的升高的转化,所以④的转化需加入氧化剂才能实现, 故答案为:④; ②在反应中,化合价升高的元素是碘元素,从-1价升高到0价,两碘元素共升高2价,化合价降低元素是铬元素,化合价从+6价降到+3价,两铬元素共降低6价,根据得失电子守恒,所以反应转移的电子数为6,电子转移的方向和数目为: 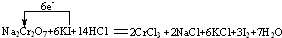 ,化合价升高的元素对应的产物单质碘是氧化产物,转移6mol电子时,生成单质碘3mol,当转移3mol电子时,则生成碘单质1.5mol,质量是:1.5ml×254g/mol=381g, 故答案为: 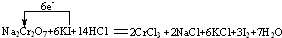 ,381g. |
相似问题
从元素化合价变化分析 下列变化中必须加入氧化剂才能发生的是(不考虑分解反应)( )A.I-→I2B
从元素化合价变化分析,下列变化中必须加入氧化剂才能发生的是(不考虑分解反应)( )A.I-→I2B.Na2SO3→SO2C.SO2→SD.HCO3-→CO32-
下列反应中 属于氧化还原反应的是( )A.Na2CO3+2HCl=2NaCl+H2O+CO2↑B.
下列反应中,属于氧化还原反应的是( )A.Na2CO3+2HCl=2NaCl+H2O+CO2↑B.SO3+H2O=H2SO4C.4HCl(浓)+MnO2△ MnCl2+Cl2↑+2H2OD.CaCO3高温 CaO+CO2↑
下列各组物质间反应 其中水既不作氧化剂又不作还原剂的氧化-还原反应是:( )①Na+H2O ②N
下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化-还原反应是:( )①Na+H2O②Na2O2+H2O③CO2+H2O④Na2O+H2O⑤Cl2+H2O⑥NO2+H2O.A.①③
已知重铬酸钾K2Cr2O7和浓盐酸在常温下反应可生成氯气 试回答下列问题:(1)请完成并配平如下的化
已知重铬酸钾K2Cr2O7和浓盐酸在常温下反应可生成氯气,试回答下列问题:(1)请完成并配平如下的化学方程式(将未知物的化学式和化学计量数填入)______K
ClO2是新一代饮用水的消毒剂 许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示












