实验室制取H2的反应方程式为:Zn+H2SO4===ZnSO4+H2↑。 (1)该反应中______
| 实验室制取H2的反应方程式为:Zn+H2SO4===ZnSO4+H2↑。 (1)该反应中________被氧化,_______发生还原反应。 (2)反应过程中转移2 mol电子,生成标准状况下的H2________L。 (3)用双线桥法表示出电子转移的方向和数目: ______________________________________________________________________。 |
参考解答
| (1)Zn;H2SO4 (2)22.4 |
(3)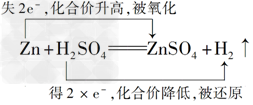 |
相似问题
甲 乙代表2种金属 下列叙述中 不能判断金属活动性甲比乙强的是A.常温下 甲能从水中置换出氢 而乙不
甲、乙代表2种金属,下列叙述中,不能判断金属活动性甲比乙强的是A.常温下,甲能从水中置换出氢,而乙不能B.最高价氧化物对应的水化物碱性比较,甲比乙
金属铜的提炼多从黄铜矿开始 已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2
金属铜的提炼多从黄铜矿开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2==Cu2S+2FeS+SO2,下列说法不正确的是
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4→MnO2+K2O+O2(240℃)。下列说法不
用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4→MnO2+K2O+O2(240℃)。下列说法不正确的是[ ]A.每生成11 2 L氧气一定转移了2mol电子B.相同质量的K
下列判断正确的是( )A.等质量的硫蒸气和硫固体分别完全燃烧 后者放出热量多B.C Si和Ge的最
下列判断正确的是( )A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8C.若,则氧化性:A
下列变化过程需要加入还原剂才能实现的是[ ]A.Na→NaOH B.CO32-→CO2 C.
下列变化过程需要加入还原剂才能实现的是[ ]A.Na→NaOH B.CO32-→CO2 C.Fe2O3→Fe D.MnO4-→Mn2+












