碳酸钠是造纸 玻璃 纺织 制革等工业的重要原料.工业碳酸钠(纯度约98%)中含有Ca2+ Mg2+
碳酸钠是造纸、玻璃、纺织、制革等工业的重要原料.工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO等杂质,提纯工艺流程如图1,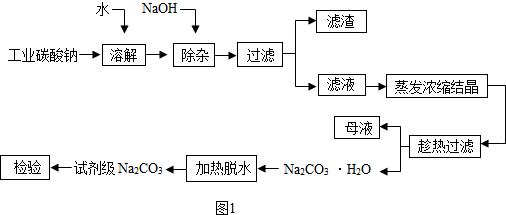 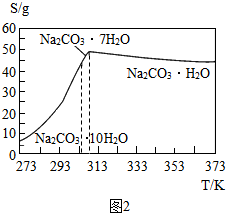 已知碳酸钠的溶解度(S)随温度变化的曲线如图2所示: 回答下列问题: (1)滤渣的主要成分为______. (2)“趁热过滤”的原因是______. (3)若在实验室进行“趁热过滤”,可采取的措施是______(写出1种). (4)若“母液”循环使用,可能出现的问题及其原因是______. |
参考解答
| (1)工业碳酸钠(纯度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成沉淀Mg(OH)2、Fe(OH)3、CaCO3,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3. 故答案为:Mg(OH)2、Fe(OH)3、CaCO3; (2)根据所给的坐标图可以发现:温度减少至313K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体,所以“趁热过滤”的原因是使析出的晶体为Na2CO3?H2O,防止因温度过低而析出Na2CO3?10H20晶体或Na2CO3?7H20晶体,使后续的加热脱水耗时长.故答案为:使析出的晶体为Na2CO3?H2O,防止因温度过低而析出Na2CO3?10H2O晶体,令后续加热脱水耗时长; (3)在实验室进行“趁热过滤”时,要注意减少过滤的时间和保持过滤时的温度,可采取的措施是用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤).故答案为:用已预热的热滤漏斗或用热毛巾捂住漏斗的外壁进行过滤; (4)根据流程图内容“母液”中存在氯离子和硫酸根离子,若参与循环,将使离子浓度增大,导致产品纯度降低.故答案为:产品纯度降低,因为“母液”多次循环后Cl-、SO42- 累积导致产生杂质氯化钠和硫酸钠. 故答案为:(1)Mg(OH)2、Fe(OH)3、CaCO3 (2)使析出的晶体为Na2CO3?H2O,防止因温度过低而析出Na2CO3?10H2O晶体,令后续加热脱水耗时长 (3)用已预热的热滤漏斗或用热毛巾捂住漏斗的外壁进行过滤 (4)产品纯度降低,因为“母液”多次循环后Cl-、SO42- 累积导致产生杂质氯化钠和硫酸钠. |
相似问题
A~G是初中常见的7种物质 它们有如下图所示的转化关系。 已知A C是无色液体 B F G是无色气体
A~G是初中常见的7种物质,它们有如下图所示的转化关系。 已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净
下图中A-H均为初中化学常见物质 各物质之间有如图所示反应关系 其中“→”表示物质间的转化关系 “-
下图中A-H均为初中化学常见物质,各物质之间有如图所示反应关系,其中“→”表示物质间的转化关系,“-”表示物质间能够相互反应。请根据下图回答问题
A~J都是初中化学中的常见物质 且有如图所示转化关系(反应条件其他生成物均已略去)。已知A为金属单质
A~J都是初中化学中的常见物质,且有如图所示转化关系(反应条件其他生成物均已略去)。已知A为金属单质、其它均为化合物, C为大理石的主要成分,E为一
下列物质间的转化 不能一步实现的是( )A.FeCl3-→Fe (OH)3B.HCl-→H2SO4
下列物质间的转化,不能一步实现的是( )A.FeCl3-→Fe(OH)3B.HCl-→H2SO4C.NaCl-→NaNO3D.CO2-→CaCO3
已知X是有毒且不溶于水的气体 Y是不支持燃烧的气体 Z是不溶于水的固体 X Y Z之间有如下转化关系
已知X是有毒且不溶于水的气体,Y是不支持燃烧的气体,Z是不溶于水的固体,X、Y、Z之间有如下转化关系(如下图)。请回答下列问题。(1)写出X的化学式_____












