将18 g铜和铁的混合物投入200 mL稀硝酸中 充分反应后得到标准状况下2.24 L NO 剩
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
|
参考解答
| A |
第一次加硝酸时金属有剩余,溶液中一定不含Fe3+,所以1 mol金属参加反应均失去2 mol电子,生成2.24 L NO转移0.3 mol电子;消耗金属0.15 mol,质量为18 g-9.6 g='8.4' g,则第一次溶解的金属的摩尔质量为56 g·mol-1,是铁。同理:第二次溶解的金属的摩尔质量为64 g·mol-1,是铜。依据3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,可知c(HNO3)= 3Cu(NO3)2+2NO↑+4H2O,可知c(HNO3)=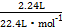 ×4÷0.2 L='2' mol·L-1;D选项,再加入硝酸,HNO3与0.15 mol Fe2+反应,依据电荷守恒可知生成0.05 mol NO,错误 ×4÷0.2 L='2' mol·L-1;D选项,再加入硝酸,HNO3与0.15 mol Fe2+反应,依据电荷守恒可知生成0.05 mol NO,错误 |
相似问题
某离子反应中涉及H2O ClO— NH4+ H+ N2 Cl—六种微粒。其中N2的物质的量随时间变化
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如右图所示。下列判断正确的是:A该反应的还原剂是Cl—B消
A B C D F是常见的化合物 其中F在常温下是一种无色液体 D为强酸 请根据下图转化关系(反应条
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据下图转化关系(反应条件及部分产物已略去),回答下列问题:(1)若A、B、C
利用I2O5可消除CO污染或定量测定CO 反应为:5CO(g)+I2O5(s) 5CO2(g)+I2
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 22I2(s
已知OCN-中每种元素都满足8电子稳定结构 在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物
将51.2 g Cu完全溶于适量浓硝酸中 收集到氮的氧化物(含NO N2O4 NO2)的混合物共0.
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol L NaOH溶液完全吸收,












