为了测定某铜银合金成分 将30 g合金完全溶于80 mL 13.5 mol/L的浓硝酸中 待反应完全
为了测定某铜银合金成分,将30 g合金完全溶于80 mL 13.5 mol/L的浓硝酸中,待反应完全后,收集到0.3 mol气体,并测得溶液中c(H+)是1 mol/L。假设反应后溶液体积仍为80 mL,则合金中银的质量分数为
|
参考解答
| A |
试题分析由于HNO3的还原产物为NO或NO2或二者的混合物,根据N原子守恒:则被还原的HNO3的物质的量等于气体的物质的量:n(HNO3)='=0.3' mol,设合金中银的质量为x,则 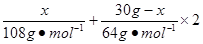 =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol,x='10.8' g =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol,x='10.8' g银的质量分数:w(Ag)= 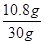 ×100%=36%。 ×100%=36%。 |
相似问题
在一个氧化还原反应体系中反应物 生成物共六种粒子 Fe3+ NO3— Fe2+ NH4+ H+ H2
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO3—、Fe2+、NH4+、H+、H2O,下列叙述正确的是A.该反应说明Fe(NO3)2溶液不宜加酸酸化B.该
某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理 反应中铁元素
某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3,其中Cr
某金属硝酸盐受热分解生成金属氧化物 二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1 则
某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是[ ]A.降
铬铁矿的主要成分的化学式为FeO·Cr2O3 还含有SiO2 Al2O3等杂质。工业上常采用固体碱熔
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:已知:①NaFeO2遇水强烈
15.8gKMnO4与100mL12mol/L过量浓盐酸充分反应 化学方程式如下:2KMnO4+16
15 8gKMnO4与100mL12mol L过量浓盐酸充分反应,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O,通过计算回答: (1)产生的Cl2在标准状况下的












