常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl
| 常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O (1)用“双线桥法”标明反应中电子转移的方向和数目。 (2)又已知 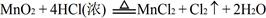 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L。 |
参考解答
(1)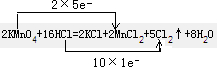 (2)KMnO4 MnO2 Cl2 (3)2 22.4 (2)KMnO4 MnO2 Cl2 (3)2 22.4 |
试题分析:(1)双线桥法标出反应中电子得失数目为 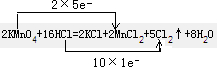 ; ;(2)2KMnO4 +16HCl(浓)='2KCl' +2MnCl 2+5Cl 2↑ +8H2O此反应制取Cl2不需要条件,而在反应 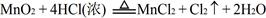 中要加热,且MnO2是氧化剂, Cl2是氧化产物。所以有氧化性KMnO4 >MnO2 >Cl2 中要加热,且MnO2是氧化剂, Cl2是氧化产物。所以有氧化性KMnO4 >MnO2 >Cl2(3)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:10 :16 =5 :8 ,63.2g (即0.4mol)KMnO4完全反应时,产生的Cl2为1.0mol,在标准状况下的体积为1.0mol×22.4L/mol=22.4L,消耗的HCl为3.2mol,被氧化的HCl为2.0mol. |
相似问题
2010年10月1日下午18时59分57秒 中国探月工程先导星“嫦娥二号”在西昌点火升空 准确入轨。
2010年10月1日下午18时59分57秒,中国探月工程先导星“嫦娥二号”在西昌点火升空,准确入轨。月球上有着非常丰富的钛铁矿(主要成分是FeTiO3)资源。已知钛
汽车剧烈碰撞时 安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判断不正确的是A.若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化B
氰化物有剧毒 在碱性条件下可用如下方法进行处理:。下列判断错误的是A.上述反应中的氧化剂是B.还原性
氰化物有剧毒,在碱性条件下可用如下方法进行处理:。下列判断错误的是A.上述反应中的氧化剂是B.还原性:>C.当有0 2生成时,溶液中阴离子的物质的量
某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。(2)已知0 2
硝酸是一种强氧化性 腐蚀性的强酸 其还原产物因硝酸浓度的不同而有变化 从总体上说 硝酸浓度越高 平均
硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产












