含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理 反应中铁元素和铬元
含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
|
参考解答
| C |
A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO?FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,A正确;B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为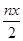 mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确. mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.选:C. |
相似问题
已知在酸性溶液中 下列物质氧化KI时 自身发生如下变化: 如果分别用等物质的量的这些物质氧化足量的K
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )A.Fe3+B.MnO4-C.Cl2D.HNO2
(8分)⑴1mol H2SO4中含______mol个氧原子 个氢原子。⑵
(8分)⑴1mol H2SO4中含______mol个氧原子,个氢原子。⑵3 6g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是。
多硫化钠Na2Sx(x>2)在结构上与Na2O2 FeS2 CaC2等有相似之处。Na2Sx在碱性溶
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的
Ag2 Se单晶呈六角微型管状 有望开发为新型材料 其制取原理为:4AgCl+3Se +6NaOH
Ag2 Se单晶呈六角微型管状,有望开发为新型材料,其制取原理为:4AgCl+3Se +6NaOH2Ag2Se+ Na2SeO3+4NaCl+3H2O关于该反应下列叙述正确的是()A.AgCl
下列说法正确的是A.含4molHCl的浓盐酸与足量MnO2充分反应 转移2NA个电子B.500℃ 3
下列说法正确的是A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子B.500℃、30MPa下,将0 2mol N2和0 6molH2置于密闭的容器中充分反应生成NH3(g












