黑火药是中国古代四大发明之一 它的爆炸反应为:2KNO3+3C+S K2S+N2↑+3a 已配平①
| 黑火药是中国古代四大发明之一,它的爆炸反应为: 2KNO3+3C+S 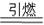 K2S+N2↑+3a 已配平 K2S+N2↑+3a 已配平①画出氮原子的结构示意图 。 ②生成物中除氮气与硫化钾外,还有一种物质A生成,则A的化学式为 。 ③黑火药中位于元素周期表短周期的元素有 种;其中一种元素的氧化物可用于漂白纸浆、丝、草帽辫等并能用于杀菌、消毒,该元素在周期表中的位置是 ,写出该氧化物通入FeCl3溶液反应的离子方程式 。 ④下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的是 。
2×10-18 mol/L的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)。 。 |
参考解答
| (共16分,每空2分,第⑤小题4分) ① 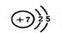 ②CO2 ③4 第3周期 ②CO2 ③4 第3周期 (各1分) (各1分)2Fe3+ + SO2 + 2H2O = 2 Fe2+ + SO42-+ 4H+ ④ A、C(各1分,有错计0分) ⑤∵ c(S2-)·c(Cu2+)=1×10-18×1×10-18=1×10-36<1.3×10-36,∴无CuS沉淀生成 |
试题分析:①氮原子原子序数是7,外层排布依次为2、5。 ②根据质量守恒定律得A为CO2。 ③短周期元素的原子序数<19,故N、O、C和S这四种元素是短周期元素,S的氧化物可以漂白,S位于第3周期  。SO2具有还原性,FeCl3具有氧化性,发生氧化还原反应,离子方程式为2Fe3+ + SO2 + 2H2O = 2 Fe2+ + SO42-+ 4H+。 。SO2具有还原性,FeCl3具有氧化性,发生氧化还原反应,离子方程式为2Fe3+ + SO2 + 2H2O = 2 Fe2+ + SO42-+ 4H+。点评:本题主要考查氧化还原反应和溶解平衡的计算,本题中注意从化合价的角度分析氧化还原反应,难度中等。 |
相似问题
若(NH4)2SO4在加热分解的产物是SO2 N2 NH3和H2O 则该反应中化合价发生变化和未发生
若(NH4)2SO4在加热分解的产物是SO2,N2,NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为()A.1:2B.2:1C.1:4D.4:1
某温度下 将Cl2通入NaOH溶液中 反应得到NaCl.NaClO.NaClO3的混合溶液 经测定C
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl NaClO NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被
在反应KClO3+6HCl=KCl+3Cl2+3H2O中 被还原和被氧化的氯原子的质量比为A.1 :
在反应KClO3+6HCl=KCl+3Cl2+3H2O中,被还原和被氧化的氯原子的质量比为A.1 :6B.6 :1C.1 :5D.5 :1
(6分)(1)请将5种物质:N2O FeSO4 Fe(NO3)3 HNO3和Fe2(SO4)3分别填
(6分)(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。________+________→_______
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。Ⅰ.一定条件下硝酸铵受热分解的化学反应方
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)(1












