位于短周期的四种元素A B C D 其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高
| 位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径 最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题: (1)写出由上述元素形成的具有漂白作用的3种物质的化学式: 、 、 。 (2)写出含B元素质量分数最高的化合物的电子式: 。 (3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式: 。 (4)用电子式表示化合物C2B的形成过程: 。 |
参考解答
| (1)SO2 H2O2 Na2O2(或O3等合理答案) (2) 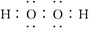 (3)HSO3-+H+=H2O+SO2↑ (4)  |
| 根据题干信息可推出A、B、C、D分别是H、O、Na、S。(1)SO2、H2O2、Na2O2、O3等都有漂白作用。(2)符合条件的化合物的最简式应该含有最多的氧原子,而另一种元素的相对原子质量越小、原子个数越少越好,H就满足这个条件。综合考虑知,含氧元素质量分数最高的化合物应该是H2O2。(3)分别由A、B、C、D四种元素组成的两种化合物应该是NaHSO3和NaHSO4。 |
相似问题
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X位于周期表前四周期 Y
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢
下列事实不能说明Cl原子的得电子能力比S原子强的是( )①HCl比H2S稳定②HClO氧化性比H2
下列事实不能说明Cl原子的得电子能力比S原子强的是()①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤Cl原子最外层有
硼有两种天然同位素10B和11B 硼元素的相对原子质量为10.8 则10B与11B的物质的量之比为(
硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为()A.1∶4B.1∶2C.1∶1D.1∶3
短周期元素X Y Z W R的原子序数依次增大 X单质在暗处与H2剧烈化合并发生爆炸 Y位于第IA族
短周期元素X、Y、Z、W、R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y位于第IA族,Z所处的周期序数与族序数相等,W元素最高正价与最低负价
下表中列出五种短周期元素A B C D E的信息 请推断后回答:元素有 关 信 息A元素主要化合价为
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:元素有关信息A元素主要化合价为-2,原子半径为0 074 nmB所在主族序数与所在周期序数之差












