A~E五种元素中 除E外均为短周期元素 且原子序数依次增大。它们的原子结构或性质如下表所示:元素AB
| A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子 结构或性质如下表所示:
(1)元素D在周期表中的位置为 。 (2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。 (3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。 (4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e-  2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。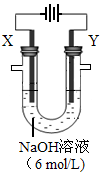 (5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下: a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol 表示生成1 mol H2Se的反应热是 (填序号);依据是: 。 |
参考解答
| (1)第三周期第ⅥA (2)离子键、非极性共价键 (3) 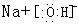 ;Na2S、NaHS、Na2SO3 ;Na2S、NaHS、Na2SO3(4)Fe-6e-+8OH-= FeO42-+4H2O;0.28g; (5)a O、S、Se同主族,气态氢化物的稳定性逐渐减弱,即与氢气化合的能力逐渐减弱,反应放出的热量逐渐减少,吸收能量逐渐增加 |
试题分析:(1)B地壳中含量最多的元素,B是O元素,则D是S元素,在元素周期表中位于第三周期第ⅥA (2)C可与B形成阴阳离子个数比为1:2的两种化合物,且C的原子序数大于8,所以C是Na元素,形成的化合物是过氧化钠,含有的化学键类型为离子键、非极性共价键; (3)A是H元素,甲能抑制水的电离,说明甲为碱,结合H、O、Na、S形成的强电解质,所以甲为氢氧化钠,其电子式为 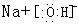 ;乙能促进水的电离,说明乙是水解显碱性的盐,所以乙为硫化钠Na2S、硫氢化钠NaHS、亚硫酸钠Na2SO3, ;乙能促进水的电离,说明乙是水解显碱性的盐,所以乙为硫化钠Na2S、硫氢化钠NaHS、亚硫酸钠Na2SO3,(4)E为铁,该装置制取高效净水剂Na2FeO4,所以Y极除生成氧气外还有Na2FeO4生成,电极反应方程式为Fe-6e-+8OH-= FeO42-+4H2O;X极产生氢气,得电子的物质的量为0.672L/22.4L/mol×2=0.06mol,Y极产生氧气,失电子的物质的量为0.168L/22.4L/mol×4=0.03mol,所以铁失电子的物质的量是0.06-0.03=0.03mol,则铁溶解的质量为0.03mol÷6×56g/mol=0.28g; (5)O、S、Se同主族,气态氢化物的稳定性逐渐减弱,即与氢气化合的能力减弱,反应放出的热量逐渐减少,吸收能量逐渐增加,所以选a。 |
相似问题
(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数
(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式。(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的
一定量的锎(98252Cf)是有用的中子源 在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误
一定量的锎(98252Cf)是有用的中子源,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是()A.98252Cf原子中,中子数为154B.98252Cf原
如下图是元素周期表短周期的一部分 A C两种元素的核外电子数之和等于B的核外电子数。下列叙述正确的是
如下图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数。下列叙述正确的是A.A元素位于第二周期、ⅥA族B.原子半径C>B>AC
下列叙述正确的是( )A.乙酸与丙二酸互为同系物B.不同元素的原子构成的分子只含极性共价键C.和是
下列叙述正确的是( )A.乙酸与丙二酸互为同系物B.不同元素的原子构成的分子只含极性共价键C.和是中子数不同质子数相同的同种核素D.短周期第ⅣA与ⅦA
某元素的核电荷数是电子层数的5倍 其质子数是最外层电子数的3倍 该元素的原子结构示意图为 。
某元素的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为 。












