(15分)某无色溶液中可能含有NH4+ K+ Al3+ HCO3— Cl— MnO4— SO42—等
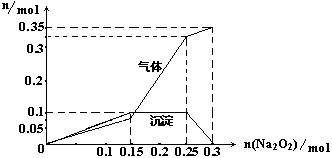
| (15分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。 ①经实验可知溶液明显呈酸性,且焰色反应呈现出紫色。 ②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。 ③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。 (1)该溶液中一定不含有 (填离子的化学式)离子,一定含有的离子有 (填离子的化学式); (2)在这些不存在的离子中,有一种离子在酸性环境中和碱性环境中都不能存在,试写出该离子与酸反应的离子方程式: ; (3)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:
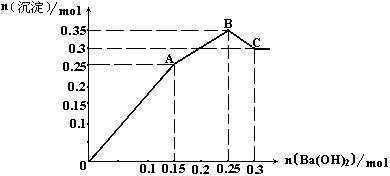
①该溶液中焰色反应呈现紫色的离子的物质的量为: mol, ②写出n(Na2O2)=0.2mol时反应的总离子方程式: ; (4)将0.1mol明矾晶体与等物质的量的某无水盐晶体X混合后溶解于水中,所得溶液与上述溶液所含离子种类完全相同。若向该溶液中加入Ba(OH)2溶液,所得沉淀的物质的量与所加入Ba(OH)2的物质的量的关系如图Ⅱ:
试根据图像推断①X的化学式: ,②图像中A点溶液中的离子成分和物质的量分别是: ; |
参考解答
| (1)HCO3—、Cl—、MnO4—(2分),K+、NH4+、Al3+、SO42—(2分); (2)HCO3—+H+=CO2↑+H2O(2分); (3)①0.1(2分) ②Al3++NH4++2Na2O2+H2O=Al(OH)3↓+NH3↑+O2↑+4Na+(2分); (4)①(NH4)2SO4 (2分); ②0.1mol K+、0.2mol NH4+、0.15mol SO42—(3分)。 |
| 根据题意和实验现象说明一定无HCO3—、Cl—、MnO4—;一定含有的K+、NH4+、Al3+、SO42—离子。 |
相似问题
下列对化学反应的表示正确的是( )A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2
下列对化学反应的表示正确的是( )A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O4H++2Cu+O2↑B.含氢氧化钠20 0 g的稀溶液与足量盐酸反应放出28
某溶液中存在较多的H+ SO42- NO3- 则溶液中还可能大量存在的离子组是A.Mg2+ Ba2+
某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是A.Mg2+、Ba2+、Br-B.Al3+、CH3COO-、Cl-C.Mg2+、Cl-、Fe2+D.Na+、NH4+、Cl-
在pH=0或pH=14的水溶液中 都能大量共存的离子组是A.Cu2+ Na+ Mg2+ NO3-B.
在pH=0或pH=14的水溶液中,都能大量共存的离子组是A.Cu2+ Na+ Mg2+ NO3-B.K+ Cl- Br- SO42-C.SO32- Na+ K+ AlO2-D.HPO42- NH4+Ag+NO3—
下列电离方程式正确的是( )A.NaHS溶于水:NaHSNa++HS-B.(NH4)2SO4溶于
下列电离方程式正确的是()A.NaHS溶于水:NaHSNa++HS-B.(NH4)2SO4溶于水:(NH4)2SO42+C.氢氟酸溶液:HF+H2OH3O++F-D.NaHCO3溶于水:NaHCO3Na++H++
下列各离子组 因发生氧化还原反应而不大量共存的是A.K+ Na+ HSO3- NO3-B.Mg2+
下列各离子组,因发生氧化还原反应而不大量共存的是A.K+ Na+ HSO3- NO3-B.Mg2+ Al3+ SO42- OH-C.K+ Fe2+ Cl- S2-D.K+ Ba2+ NO3- SO32-