以海水中常见物质NaCl为原料可以发展很多种工业 (1)写出电解饱和食盐水的化学方程式_______
| 以海水中常见物质NaCl为原料可以发展很多种工业, (1)写出电解饱和食盐水的化学方程式______________________。 (2)以氯碱工业中的某些物质为原料制取漂白粉的化学方程式是_______________________ (3)从海水中获取的食盐中通常含有少量的MgCl2、Na2SO4等杂质,现采取下列方案将其提纯,其合理的操作顺序是________________________________ ①取一定量的食盐晶体溶于水 ②加入过量的NaOH溶液 ③加入过量的BaCl2溶液 ④过滤 ⑤蒸发溶液 ⑥加入过量的Na2CO3溶液 ⑦加入适量的盐酸,调节溶液的pH Ⅱ:2007年11月18日凌晨乌克兰一煤矿因瓦斯爆炸而发生矿难,死亡人数超过100人;2007年12月12日,河南省某煤矿因发生煤矿瓦斯突发事故而导致12名矿工遇难.瓦斯是CH4和CO混合而成的有毒气体,遇到明火极易发生爆炸 (4)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比 (5)已知在101kPa时,CO的燃烧热为283kJ/mol,相同条件下若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,写出CH4完全燃烧的热化学方程式 120℃,101kPa下,a ml由CO、CH4组成的混合气体在bmlO2中完全燃烧后,恢复到原温度和压强 (6)若混合气体和O2恰好完全反应,产生bmlCO2,则混合气体中CH4的体积分数为 (7)若燃烧后气体体积缩小了a/4ml,写出a与b必须满足的关系式 |
参考解答
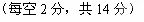 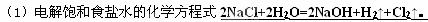 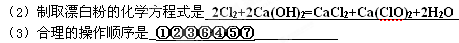 Ⅱ:(4),转移的电子数之比1:4 (5)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H='-891.45kJ/mol' (6) CH4的体积分数为 33.3% (7) a与b必须满足的关系式 4b≥5a |
(1)电解饱和食盐水: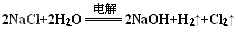 (2)制取漂白粉的原理是利用:氯气与碱反应生成盐、次氯酸盐、水。生成的次氯酸盐具有强氧化性,可用于漂白。其方程式: 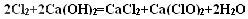 (3)除去食盐中含有少量的MgCl2、Na2SO4等杂质所需试剂:NaOH、BaCL2、Na2CO3、HCL,加入试剂必须符合:BaCL2放在Na2CO3之前,HCL一定放在最后的原则。  (4)等体积的CO和CH4在相同条件下的物质的量之比为1:1,可令其物质的量分别为1mol,CO中C元素化合价将由+2价升高到+4价,转移电子数为2mol;CH4中C元素化合价将由-4价升高到+4价,转移电子数为8mol; (5)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-891.45kJ/mol (6)设CO有(a-x)mL,CH4有x mL;则 根据C守恒得:a='b' ①; 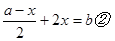 ;解得 ;解得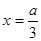 (7)对于反应2CO+O2====2CO2为气体体积减小的反应,对于反应CH4+2O2====CO2+2H2O120℃,101kPa下,为等体积反应;由方程式 2CO+O2====2CO2气体体积减小△V 2 1 2 1 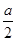 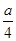 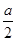 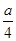 CH4+2O2====CO2+2H2O 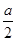 a a 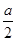 a a即 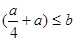 ,得4b≥5a ,得4b≥5a |
相似问题
把一定量的铁粉放入氯化铁溶液中 充分反应后所得溶液中Fe3+和Fe2+的浓度恰好相等 则反应的铁和未
把一定量的铁粉放入氯化铁溶液中,充分反应后所得溶液中Fe3+和Fe2+的浓度恰好相等,则反应的铁和未反应的Fe3+的物质的量之比为A.1︰3B.1︰2C.1︰1D.3︰1
在空气中长时间放置少量金属钠 最终的产物是( )(A)NaOH (B)Na2O
在空气中长时间放置少量金属钠,最终的产物是()(A)NaOH(B)Na2O(C)Na2CO3(D)Na2O2
把一小块钠投入到硫酸铜溶液中 生成物不可能有的是( )A.CuB.Cu(OH)2C.H2D.CuO
把一小块钠投入到硫酸铜溶液中,生成物不可能有的是( )A.CuB.Cu(OH)2C.H2D.CuO
甲 乙 丙 丁四个烧杯中 依次分别放入0.1 mol的Na Na2O Na2O2 NaOH 然后各加
甲、乙、丙、丁四个烧杯中,依次分别放入0 1 mol的Na、Na2O、Na2O2、NaOH,然后各加水100 g,待完全溶解后,甲、乙、丙、丁四种溶液,溶质的质量分数的
将一小快金属钠投入到盛放FeCl2溶液的烧杯中 观察到的现象是__________________有
将一小快金属钠投入到盛放FeCl2溶液的烧杯中,观察到的现象是__________________有关的离子方程式是____________________。












