1862年 比利时化学家索尔维发明了氨碱法制碱 1926年 我国化学家侯德榜创立了更为进侯德榜制碱法
| 1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了 更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图: 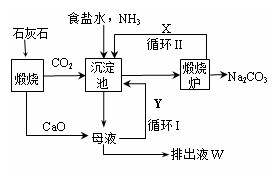 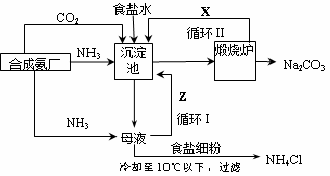 氨碱法生产流程 联合制碱法生产流程 (1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 。 (2)沉淀池中发生反应的化学反应方程式是 从沉淀池中分离沉淀的操作是 。 (3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。 (4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。 a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气能增大NH4+的浓度,使氯化铵更多析出 c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出 d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 (5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 。 (6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 。 |
参考解答
| (1)因为CO2溶解度小,而NH3易溶于水,先通入NH3有利于后面CO2的吸收(2分) (2)NH3+CO2+NaCl+H2O═NaHCO3↓+NH4Cl( 2分,无”↓”扣1分) 过滤(1分) (3)NH3 ( 2分) CaCO3+2NaCl═Na2CO3+CaCl2( 2分) (4)bd( 2分) (5)避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备。( 2分) (6) 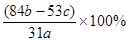 ( 2分) ( 2分) |
试题分析:(1)氨气溶解度大,通入氨气后使溶液显碱性,吸收二氧化碳的量增加;(2)沉淀池中氨气、二氧化碳和氯化钠反应生成碳酸氢钠晶体,过滤得碳酸氢钠;(3)沉淀池中的母液是氯化铵溶液,加入的氧化钙和水反应生成氢氧化钙,氢氧化钙和氯化铵反应生成氨气,将氨气在通入沉淀池中循环利用,故Y为氨气;从理论上分析,氨碱法生产过程中,母液中加入氧化钙,和水反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气; NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,故答案为: CaCO3+2NaCl═Na2CO3+CaCl2;(4)联碱法中从母液中提取氯化铵晶体的过程中;a、常温时氯化铵的溶解度比氯化钠大,故a错误;b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b、d正确;c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;(5)联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵.将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,(6)写出碳酸氢钠分解的化学方程式,设固体中含碳酸氢钠的质量为x,当反应掉2mol即168g碳酸氢钠时,固体质量减少62g,根据质量差法计算出固体中含碳酸氢钠的质量,用总质量减去碳酸氢钠的质量得固体中碳酸钠的质量,从而求出质量分数。 |
相似问题
关于钠原子与钠离子 下列叙述错误的是 [ ]A.它们相差1个电子层 B.它们的化学性质相似
关于钠原子与钠离子,下列叙述错误的是 [ ]A.它们相差1个电子层 B.它们的化学性质相似 C.钠原子比钠离子稳定 D.钠原子、钠离子均为钠元素
下列有关物质性质的应用正确的是A.钠具有很强的还原性 可用钠与TiCl4溶液反应制取钛B.铝表面易形
下列有关物质性质的应用正确的是A.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛B.铝表面易形成致密的氧化膜,可用铝制贮罐盛装稀硝酸C.酒精是良
等质量的两块钠 第一块在足量氧气中加热燃烧 第二块在足量氧气(常温)中充分反应 则下列说法正确的是:
等质量的两块钠,第一块在足量氧气中加热燃烧,第二块在足量氧气(常温)中充分反应,则下列说法正确的是: [ ]①两块钠失去电子一样多 ②第一块钠失去
下列有关钠的叙述中 错误的是 [ ]A.钠的还原性很强 可以用来冶炼钛 锆 铌等 B.钠的化
下列有关钠的叙述中,错误的是 [ ]A.钠的还原性很强,可以用来冶炼钛、锆、铌等 B.钠的化学性质非常活泼,钠元素只能以化合态形式存在于自然界中 C
将一小块金属钠长期露置于空气中发生一系列变化 最终产物是:[ ]A.NaOH
将一小块金属钠长期露置于空气中发生一系列变化,最终产物是:[]A.NaOHB.Na2OC.Na2O2D.Na2CO3












