18.4 g NaOH和NaHCO3固体混合物 在密闭容器中加热到250 ℃ 经充分反应后排出气体
| 18.4 g NaOH和NaHCO3固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却后称得剩余固体质量为16.6 g,计算原混合物中NaOH的质量分数。 |
参考解答
| 54.3% |
| NaOH和NaHCO3的固体混合物在加热条件下,先发生酸式盐和碱的中和反应: NaHCO3+NaOH 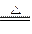 Na2CO3+H2O↑ ① Na2CO3+H2O↑ ①若NaOH过量,则只发生反应①;若NaHCO3过量,则过量的NaHCO3继续受热分解,发生反应: 2NaHCO3 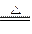 Na2CO3+H2O↑+CO2↑ ② Na2CO3+H2O↑+CO2↑ ②因此,计算前,必须先根据反应①的质量差判断NaHCO3是否过量。  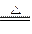 Na2CO3+H2O↑ Δm Na2CO3+H2O↑ Δm124 18 18.4 g x 解得 x='2.67' g 若实际质量差='2.67' g,则NaHCO3、NaOH恰好完全反应; 若实际质量差>2.67 g,则NaHCO3过量,发生反应①和②; 若实际质量差<2.67 g,则NaOH过量,只发生反应①。 现实际固体质量差为18.4 g-16.6 g='1.8' g<2.67 g,则NaOH过量,按不足量的NaHCO3计算。设NaHCO3质量为y。 NaHCO3+NaOH====Na2CO3+H2O↑ Δm 84 18 y 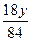 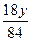 ='18.4' g-16.6 g='1.8' g ='18.4' g-16.6 g='1.8' g解得 y='8.4' g m(NaOH)='18.4' g-8.4 g='10.0' g w(NaOH)= 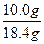 ×100%=54.3%。 ×100%=54.3%。 |
相似问题
下列说法中 正确的是 [ ]A. 硅的化学性质不活泼 在自然界中可以以游离态存在B. 工业上
下列说法中,正确的是 [ ]A 硅的化学性质不活泼,在自然界中可以以游离态存在B 工业上制备镁是用电解熔融的MgCl2来完成的C Na2O和Na2O2含有的化
钡和钠相似 也能形成O22–离子的过氧化物 则下列叙述错误的是 ( )A.1mol过氧化钠或过
钡和钠相似,也能形成O22–离子的过氧化物,则下列叙述错误的是()A.1mol过氧化钠或过氧化钡跟足量水反应都生成0 5mol氧气B.过氧化钡的化学式是Ba2O2C
下列各组内的两种物质发生反应时 其产物不随反应物用量比的改变而发生变化的是( )A.C和O2B.
下列各组内的两种物质发生反应时,其产物不随反应物用量比的改变而发生变化的是()A.C和O2B.NaOH溶液和CO2C.Na2CO3溶液和盐酸D.Na和Cl2
下列叙述中正确的是[ ]A.Na2O与Na2O2都能和水反应生成碱 它们都是碱性氧化物 B.
下列叙述中正确的是[ ]A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 B.Na2O能继续被氧化成Na2O2 C.Na2O与CO2发生化合反应生成Na2CO3,Na2
向一定量的饱和NaOH溶液中加入少量Na2O固体 恢复到原来温度时 下列说法中正确的是 [
向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是 [ ]A.溶液中的Na+总数不变 B.单位体积内的OH-数目不变 C.溶质












