盐酸 硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况 回答下列问题: (1)
| 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题: (1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为_____________________________.某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置: |
 |
| (2)在一定体积的18 mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填“>”“=”或“<”)100 mL. 有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”). (3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是______________________________________.另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:__________________________________________________________________________. |
参考解答
| (1)Cu+H2O2+2HCl===CuCl2+2H2O 作图:以铜为阳极,以盐酸为电解质溶液的电解池装置 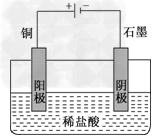 (2)>;可行 (3)不同意;等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,溶液中Cu2+将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确(其他合理答案也对) |
相似问题
将1 L pH =5的CuSO4溶液用惰性电极电解一段时间后 溶液的pH变为2。若使溶液的浓度 pH
将1 L pH =5的CuSO4溶液用惰性电极电解一段时间后,溶液的pH变为2。若使溶液的浓度、pH与电解前相同,可采用的方法是 [ ]A.向溶液中加入0 49 gCu(
现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和
现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是( )A.气体A是H2,溶液E
用石墨电极电解下列足量的各物质水溶液一段时间后 假如通过的电量相同 则产生气体的物质的量最少的是 [
用石墨电极电解下列足量的各物质水溶液一段时间后,假如通过的电量相同,则产生气体的物质的量最少的是 [ ]A.CuSO4B.Na2SO4C.CuCl2D.NaCl
某学生欲完成2HCl + 2Ag = 2AgCl + H2↑的反应 设计了如图所示的四个实验 你认为
某学生欲完成2HCl+2Ag=2AgCl+H2↑的反应,设计了如图所示的四个实验,你认为可行的实验是[ ]A B C D
如图甲所示为锌铜原电池装置 乙为电解熔融氯化钠装置。则下列说法正确的是 [ ]A.甲装置中
如图甲所示为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是 []A.甲装置中锌为负极,发生还原反应,铜为正极,发生氧化反应B.甲装置盐












