工业上常以赤铁矿石(主要成分为Fe2O3)和焦炭为主要原料 在高温下炼铁.焦炭产生CO的反应是:C+
| 工业上常以赤铁矿石(主要成分为Fe2O3)和焦炭为主要原料,在高温下炼铁.焦炭产生CO的反应是: C+O2
(1)CO还原赤铁矿的化学方程式是______ (2)下列说法正确的是______ a.为使赤铁矿石充分燃烧,需将其粉碎 b.足量的空气能提高炼铁反应速率 c.与生铁相比较,纯铁转化为“铁水”的温度低 (3)生铁的用途很多,某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,流程图1: 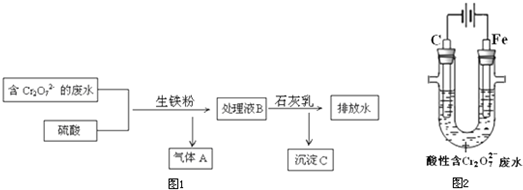 ①气体A是______ ②在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是______ ③将Cr3+转化为Cr(OH)3的离子方程式是______ (4)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图2: ①阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是______ ②一段时间后,试管底部出现沉淀.解释生成沉淀的原因:______. |
参考解答
(1)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,故答案为:Fe2O3+3CO
(2)a、原料铁矿石是固体、空气是气体,为了加快反应速率,所以要将黄铁矿粉碎,增大接触面,提高反应速率,故a正确; b、采用空气过量目的是增大氧气浓度,提高一氧化碳的浓度,提高炼铁反应速率,故b正确; c、生铁是合金,熔点低,故c错误; 故答案为:a b; (3)①铁与硫酸反应生成H2,故答案为:H2; ②生铁中含有C,铁和碳在硫酸溶液中形成原电池,故答案为:生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率; ③Cr3+与石灰乳反应生成Cr(OH)3是沉淀,离子方程式是2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+,故答案为:2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+; (4)①铁作阳极,电极本身被氧化,反应式为Fe-2e-═Fe2+,溶液呈酸性,H+离子在阴极放电生成氢气,反应式为2H++2e═H2↑,Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子,反应离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O; ②随着电解进行,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀,故答案为:随着电解进行,溶液中c(H+) 逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀; |
相似问题
如图所示是根据图甲的电解池进行电解时 某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极
如图所示是根据图甲的电解池进行电解时,某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影
用铂电极(惰性)电解下列溶液时 阴极和阳极上的主要产物分别是H2和O2的是 [ ]A.稀Na
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是[ ]A.稀NaOH溶液B.HCl溶液 C.酸性CuSO4溶液D.酸性AgNO3溶液
A B C三种强电解质 它们在水中电离出的离子如下表所示下图所示装置中 甲 乙 丙三个烧杯依次分别盛
A、B、C三种强电解质,它们在水中电离出的离子如下表所示下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接
如图所示装置 两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液 c( I) C(Ⅱ)为多孔石墨电极。 断
如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,c( I)、C(Ⅱ)为多孔石墨电极。 断开S2,接通S1后,c( I)附近溶液变红,两玻璃管中有气体生
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O 研读下图 下列判断不
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是[ ]A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H+












