B C D E均是短周期元素 原子序数依次增大 B元素原子最外层上的电子数为内层电子总数的2倍.B元
| B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层电子数之差为2.C和D形成的化合物进行焰色反应火焰呈黄色.E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应. (1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号); (2)B、C形成的化合物(比空气重)的结构式为______; (3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______; (4)E的离子结构示意图为______; (5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理. |
参考解答
| B、C、D、E均是短周期元素,B元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,则C元素原子最外层电子数为6或2,C和D形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则D为Na元素,C不能是金属元素,C的原子序数小于Na,故C为氧元素;E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物NaOH反应,则E为Cl元素, (1)上述4种元素按照原子序数由大到小排列为:Cl、Na、O、C, 故答案为:Cl;Na;O;C; (2)C、O形成的化合物(比空气重)为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为 O=C=O,故答案为:O=C=O; (3)O、Na的单质在加热条件下生成物质X为Na2O2,含有离子键、共价键,其电子式为 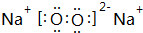 , ,故答案为:离子键、共价键;  ; ;(4)E为Cl元素,其离子结构示意图为 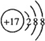 ,故答案为: ,故答案为: ; ;(5)常温下,将Na的单质投入水中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,该反应属于氧化还原反应,能作为设计原电池的反应原理, 故答案为:2Na+2H2O=2Na++2OH-+H2↑;能. |
相似问题
下列说法不正确的是( )A.NCl3 PCl3 CO2 CCl4分子中各原子均达到8e-稳定结构B
下列说法不正确的是( )A.NCl3、PCl3、CO2、CCl4分子中各原子均达到8e-稳定结构B.若R2-和M+的电子层结构相同,则原子序数:R>MC.F2、Cl2、Br2、I
已知aAn+ bB(n+1)+ cCn- dD(n+1)-均是具有相同电子层结构的短周期元素形成的简
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均是具有相同电子层结构的短周期元素形成的简单离子,下列说法正确的是( )A.原子半径C>D>A>BB.原子序
X Y Z是三种短周期的主族元素 原子序数:Z>X>Y 其中Y原子的次外层电子数为2 X与Y的族序数
X、Y、Z是三种短周期的主族元素,原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X与Y的族序数之和等于Z的族序数.已知X的氢氧化物A难溶于水,Y的最高
(1)下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ?mol-1):锂XY失去第一个
(1)下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ?mol-1):锂XY失去第一个电子519520580失去第二个电子729645701820失去第三个电子1
有A B C D E五种主族元素 其原子的最外层电子数依次为1 3 7 6 4 原 子序 数按E B
有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、3、7、6、4,原子序数按E、B、D、C、A的顺序依次增大.D的最高价氧化物的相对分子质量与气












