X Y Z M是元素周期表中前20号元素 其原子序数依次增大 且X Y Z相邻.X的核电荷数是Y的核
| X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.用微粒符号完成下列问题: (1)Y、Z两种元素的最高价氧化物的水化物酸性______强于______. (2)M、Z、Y形成的简单离子的半径的大小______. (3)M2X2固体中阴、阳离子个数比______,其电子式为______.该物质中含有化学键的类型有______和______. (4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为______. |
参考解答
| X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素.根据Y与M可形成化合物M2Y,又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素. (1)Y、Z两种元素的最高价氧化物的水化物分别为H2SO4和HClO4,非金属性S<Cl,非金属性越强,最高价氧化物的水化物酸性越强,故酸性HClO4>H2SO4. 故答案为:HClO4;H2SO4; (2)M、Z、Y形成的简单离子分别为K+、Cl-、S2-,它们的核外电子排布相同,核电荷数越大,离子半径越小,故离子半径顺序为S2->Cl->K+. 故答案为:S2->Cl->K+; (3)M2X2是过氧化钠,由钠离子和过氧根离子构成,阴、阳离子个数比为1:2,电子式为 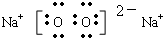 ,钠离子与过氧根离子是离子键,过氧根离子中氧原子之间为非极性键. 故答案为:1:2; 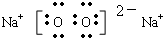 ; 离子键;非极性键; (4)氯气与二氧化硫在水中反应生成盐酸与硫酸,反应离子方程式为Cl2+SO2+2H2O═4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-. |
相似问题
已知A B C D E是短周期中的五种非金属元素 它们的原子序数依次增大.A元素原子形成的离子核外电
已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零,C、D元素周期表中处于相邻的位置,B原子的
X Y Z为原子序数由小到大排列的三种短周期元素.已知:X Y的气态氢化物分子具有相同的电子数;Y与
X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.
A B C D E F G都是短周期主族元素 它们的核电荷数依次增大.元素A的原子核内仅有一个质子
A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的
现有下列短周期元素性质的相关数据:①②③④⑤⑥原子半径(10-10m)1.300.820.991.1
现有下列短周期元素性质的相关数据:①②③④⑤⑥原子半径(10-10m)1 300 820 991 110 901 18最高或最低化合价+2+3+7+4+2+3-1-4请回答下列问题:(1)①
若aAm+与bBn-的核外电子排布相同 则下列关系不正确的是( )A.a=b+m+nB.离子半径A
若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )A.a=b+m+nB.离子半径Am+<Bn-C.原子半径A>BD.A、B一定都是短周期元素












