决定物质性质的重要因素是物质结构。请回答下列问题。(1)下图是石墨的结构 其晶体中存在的作用力有
| 决定物质性质的重要因素是物质结构。请回答下列问题。 (1)下图是石墨的结构,其晶体中存在的作用力有 (填序号) 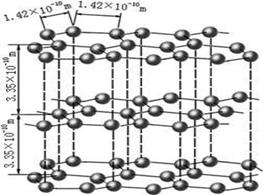 Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键 (2)下面关于晶体的说法不正确的是___________
 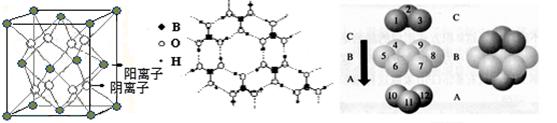 图Ⅰ 图Ⅱ 图Ⅲ ① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 , 图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ; ②H3BO3晶体中B原子杂化方式______ ; ③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 (4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示) 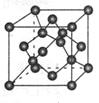 |
参考解答
| (1)A B E(2分) (2)C (1分) (3)①12 (2分) 12 (2分) ②sp2(1分) ③CaF2 > Cu >H3BO3(2分) 分子间作用力(1分) (4)8个 (2分) 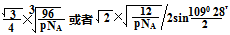 (2分) (2分) |
试题分析:(1)石墨属于混合晶体,是层状结构,每一层里是碳原子之间形成的共价键;在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键。层与层之间是依靠分子间作用力(即范德华力)相连接的。 (2)同周期金属元素的熔点随原子序数增加,熔点由高到低的顺序是Al>Na>Mg,所以C错。 (3)①由图I可以看出晶体中与F离子最近且等距离的F离子数为 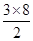 =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12; =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;②B原子都含有3个共价单键,所以采用sp2杂化; ③CaF2属于离子晶体,Cu 属于金属晶体,H3BO3属于分子晶体,不同类型晶体熔沸点判断一般来说按照原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体,H3BO3属于分子晶体,晶体受热熔化时,克服的微粒之间的相互作用为分子间作用力。 (4)晶胞中碳原子个数按照顶点8个× 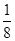 +面心6个× +面心6个×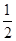 +体心3个×1=8个 +体心3个×1=8个 假设晶胞的边长为acm 晶胞的体积为a3 cm3, 晶体中最近的两个碳原子之间的距离为a 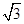 /4. /4. ρ·a3/8=12/NA.a3=(8×1/2)/ρ·NA.所以a= 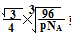 |
相似问题
某离子化合物的晶胞如右图所示立体结构 晶胞是整个晶体中最基本的重复单位。小黑球表示阳离子 小白球表示
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是A
下列图像是NaCl CsCl 干冰的晶体结构图或是从其中分割出来的部分结构图。试判断属于NaCl的晶
下列图像是NaCl、CsCl、干冰的晶体结构图或是从其中分割出来的部分结构图。试判断属于NaCl的晶体结构的图像为
石墨烯是由碳原子构成具有片状结构的新型纳米材料(结构示意图如下) 可通过剥离石墨而成 具有极好的应用
石墨烯是由碳原子构成具有片状结构的新型纳米材料(结构示意图如下),可通过剥离石墨而成,具有极好的应用前景。下列说法正确的是A.石墨烯是一种有机化合
关于SiO2晶体的叙述中 正确的是 ( )。A.通常状况下 60 g SiO2晶体中含有的分子数为
关于SiO2晶体的叙述中,正确的是 ( )。A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)B.60 g SiO2晶体中,含有2NA个Si
在某晶体中 与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间构型为正八面体形(如图)。该晶体
在某晶体中,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间构型为正八面体形(如图)。该晶体不是( )A.NaCl(x=Na+,y=Cl-)B.CsCl(x=C












