晶体具有规则的几何外形 晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。(1)晶体中每个
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。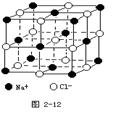 (1)晶体中每个Na+同时吸引着______个Cl-, 每个Cl-同时吸引着_______个Na+。 (2)晶体中在每个Cl-周围与它最接近且距离相等 的Cl-共有________个。 (3)在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个, 在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形中有___________个C02分子。其中,C原子的杂化类型为 。C02分子中碳氧之间有π键,而SiO2中硅氧之间无π键,原因是 。 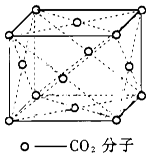 |
参考解答
| 6;6;12;12;4;sp;硅的半径大,硅与氧之间距离远,p—p电子云重叠程度小,形成π键不稳定。 |
| (1)根据晶胞的结构示意图可知,晶体中每个Na+同时吸引着6个;;最,即上下、左右和前后各1个。同样每个Cl-同时吸引着6个Na+。 (2)以晶体中顶点为中心,则Cl-周围与它最接近且距离相等的Cl-位于面心处的,1个顶点可以形成3个面,8个立方体,所以一共是3×8/2=12. (3)解答此题要求对干冰的晶体模型十分熟悉。以右下角C02分子研究对象:与其紧 邻的为面心上的3个C02分子,而CO2分子被8个这样的立方体所共有,故有3×8=24。又考虑 到面心上的 C02被2个这个的立方体共有,故24/2=12个。 由C02晶体模型分析得出,符合题 意的最小正方形即模型的角对角面的一半,不难看出有4个C02分于。CO2是直线型结构,所以 是sp杂化。因为硅原子的半径大,硅与氧之间距离远,p—p电子云重叠程度小,所以形成π键 不稳定。 |
相似问题
(10分)某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点 Y(o)位于立方体中心。试分析:(1
(10分)某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点,Y(o)位于立方体中心。试分析:(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着______
下列物质的熔点 前者大于后者的是A.晶体硅 碳化硅B.甲苯 苯酚C.氧化镁 氧化钠D.钾钠合金 钠
下列物质的熔点,前者大于后者的是A.晶体硅、碳化硅B.甲苯、苯酚C.氧化镁、氧化钠D.钾钠合金、钠
如图是氯化铯晶体的晶胞 已知晶体中2个最近的Cs+离子核间距为a cm 氯化铯的摩尔质量为M NA为
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为 阿伏加德罗常数,则氯化铯晶体的密度为()A.B.C.D.
已知下列晶体的熔点:NaCl:801℃ AlF3:1291℃ AlCl3:190℃ BCl3:
已知下列晶体的熔点:NaCl:801℃ AlF3:1291℃ AlCl3:190℃ BCl3:107℃刚玉Al2O3:2045℃ CO2:-56 6℃ SiO2:1723℃据此判断下列说法错误的是A
下表所列物质晶体的类型全部正确的一组是 原子晶体离子晶体分子晶体 A.氮化硅磷酸单质硫 B.单晶硅烧
下表所列物质晶体的类型全部正确的一组是原子晶体离子晶体分子晶体A.氮化硅磷酸单质硫B.单晶硅烧碱白磷C.金刚石硅铁冰D.铁尿素冰醋酸












