(10分)某离子晶体晶胞结构如图所示 X位于立方体的顶点 Y位于立方体中心。试分析: (1)晶体中每
(10分)某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心。试分析: 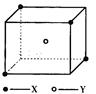 (1)晶体中每个Y同时吸引着____个X,该晶体的化学式为_____ 。 (2)晶体中在每个X周围与它最接近且距离相等的X共有________个。 (3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_______。(4)设该晶体的化学式的式量为M,晶体密度为ρ,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。 (5)下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 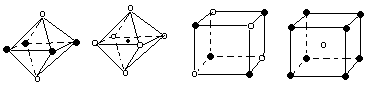 ① ② ③ ④
|
参考解答
| (1)4 XY2 (2)12 (3)109。28’ (4) 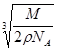 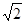 cm cm(5)B、 C (6)V形,正八面体,三角锥形,正四面体 |
试题分析::(1)X位于顶点,体心的Y吸引着4个X。每个X吸引着8个Y,如图所示:由于X粒子位于晶胞的顶点,只有 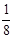 X属于该晶胞,而Y粒子位于晶胞内部,完全属于该晶胞,故该晶体中X∶Y=( X属于该晶胞,而Y粒子位于晶胞内部,完全属于该晶胞,故该晶体中X∶Y=(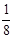 ×4)∶1,即化学式为XY2或Y2X。 ×4)∶1,即化学式为XY2或Y2X。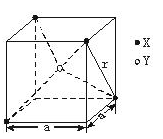 (2)每个X周围与X最接近且距离相等的X应为8×3× 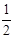 =12个。 =12个。(3)由Y粒子和X粒子间虚线可知形成正四面体构型,所以∠XYX为109°28′ (4)设该晶胞的边长为a,两个X中心间距离为r,由于每个晶胞中相当于含有( 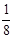 ×4)个X和一个Y,即 ×4)个X和一个Y,即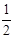 个XY2。则: 个XY2。则: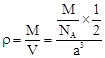 , ,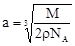 cm,又因为 cm,又因为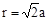 ,所以 ,所以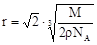 cm。 cm。(5)氯化钠晶胞的配位数是6,所以选BC。 (6)H2S分子S有两对孤对电子和2个σ键,所以VSEPR构型是正四面体,分子构型是V形,SnCl62-离子中Sn没有孤对电子有6个σ键,所以VSEPR构型是正八面体,分子构型也是正八面体,PH3中P有一对孤对电子和3个σ键,所以VSEPR构型是正四面体,分子构型是三角锥,ClO4-中Cl没有孤对电子有4个σ键,所以VSEPR构型是正四面体,分子构型也是正四面体。 点评:通过晶体结构来计算化学式,键角和距离。VSEPR构型要除去孤对电子才是分子构型。 |
相似问题
《美国化学会志》报道 中国科学家以二氧化碳为碳源 金属钠为还原剂 在 80MPa下合成出金刚石 具有
《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是A.由二氧化碳合成金
已知C3N4晶体很可能具有比金刚石更大的硬度 且原子间均以单键结合 下列关于C3N4晶体的说法正确的
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是A.C3N4晶体是分子晶体B.C3N4晶体中,C-N键的键长比
物质结构理论指出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用 叫金属键。金属键越强 其金属的
物质结构理论指出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般
氮化硅是一种新合成的超硬 耐磨 耐高温的材料。下列对氮化硅的叙述中 正确的是( )。A.氮化硅是分
氮化硅是一种新合成的超硬、耐磨、耐高温的材料。下列对氮化硅的叙述中,正确的是()。A.氮化硅是分子晶体B.氮化硅是原子晶体C.氮化硅是离子晶体D.
下列叙述正确的是A.原子晶体中 共价键键能越大 熔沸点越高;B.同主族金属的原子半径越大 熔点越高;
下列叙述正确的是A.原子晶体中,共价键键能越大,熔沸点越高;B.同主族金属的原子半径越大,熔点越高;C.分子晶体中,分子间作用力越大,该分子越稳定












