今有A B C D四种短周期元素 它们的核电荷数依次增大.A与C B与D分别是同族元素.B D两元素
| 今有A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C、B与D分别是同族元素.B、D两元素的质子数之和是A、C两元素质子数之和的2倍.这四种元素中有一种元素的单质呈淡黄色.根据你的推断回答下列问题 (1)四种元素的名称分别是:A______,B______,C______,D______ (2)请写出含B质量分数最高的化合物的化学式:______ (3)写出由上述元素形成的具有漂白作用的四种物质的化学式:______、______、______、______ (4)画出C离子结构示意图______,写出比C少一个质子的原子的电子式______ (5)分别写出由A、B两元素形成两种化合物的化学式______、______ (6)分别用电子式写出A2B2、C2B2的形成过程______、______ (7)写出NH4Cl的电子式:______,CO2的电子式:______. |
参考解答
| (1)颜色呈淡黄色的单质为S,与S同主族的短周期元素为O,二者质子数之和为16+8=24,B、D两元素的质子数之和是A、C两元素质子数之和的2倍,则B为O元素,D为S元素,A、C质子数之和为12,且同主族,二者所以A为H元素,C为Na元素,名称分别为A、氢 B、氧 C、钠 D、硫,故答案为:氢;氧;钠;硫; (2)含O质量分数最高的化合物为H2O2,故答案为:H2O2; (3)由上述元素形成的具有漂白作用的四种物质分别有Na2O2、O3、H2O2、SO2,故答案为:Na2O2;O3;H2O2;SO2; (4)C离子为Na+,原子核内有11个质子,原子核外有10个电子,结构示意图为 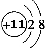 ,比Na少一个质子的原子为Ne,电子式为 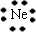 , 故答案为: 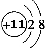 ; 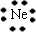 ; (5)分别写出由H、O两元素形成两种化合物分别为H2O、H2O2,故答案为:H2O;H2O2; (6)H2O2的电子式表示的形成过程为 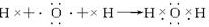 ,Na2O2的电子式表示的形成过程为  , 故答案为: 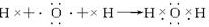 ;  ; (7)NH4Cl为离子化合物,电子式为 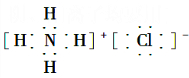 ,CO2为共价化合物,电子式为 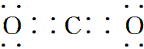 , 故答案为: 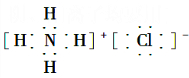 ; 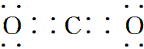 . |
相似问题
X Y Z均为短周期元素.已知x元素的某种原子核内无中子 Y元素的原子核外最外层电子数是其次外层电子
X、Y、Z均为短周期元素.已知x元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素.有下列含
如图为元素周期表的一部分 已知A B C D E5个原子共有85个电子 E原子核外有4个电子层 则B
如图为元素周期表的一部分,已知A、B、C、D、E5个原子共有85个电子,E原子核外有4个电子层,则B元素是 [ ]A.PB.MgC.ClD.Si
A B C D E五种元素原子序数依次增大 且均不超过18.其中A与C B与E分别为同族元素.原子半
A、B、C、D、E五种元素原子序数依次增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C
下列关于主族元素的说法正确的是( )A.主族元素的原子核外电子最后填入的能级是s能级B.主族元素的
下列关于主族元素的说法正确的是( )A.主族元素的原子核外电子最后填入的能级是s能级B.主族元素的原子核外电子最后填入的能级是s能级或p能级C.主
不符合原子核外电子排布基本规律的是 [
不符合原子核外电子排布基本规律的是[ ]A .核外电子总是优先排在能量最低的电子层上 B .K 层是能量最低的电子层C .N 电子层为次外层时,最多可












