(10分)已知A B C D E五种元素的原子序数依次增大 其中A原子所处的周期数 族序数都与其原子
| (10分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。 (1)E元素基态原子的核外电子排布式为___________________。 (2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号)。其原因是 。 (3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。 (4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。 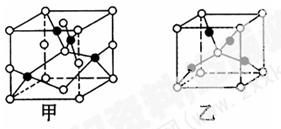 |
参考解答
| (1)1s22s22p63s23p63d104s1或[Ar3d104s1(1分) (2)C<O<N(1分),同一周期从左向右,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,故其第一电离能大于氧元素的(2分) (3)sp2(1分), 3(1分) (4)CuO(1分) Cu2O(1分) Cu2O中Cu的各轨道均为全充满状态,较稳定(2分) |
试题分析:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,则 (1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1; (2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N; (3)C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H2分子中含有3个σ键,2个π键,则lmolC2H2分子中σ键3mol; (4)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=6× 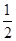 +8× +8×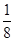 =4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8× =4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×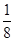 =2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙。 =2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙。 |
相似问题
已知A B C D E F都是周期表中前四周期的元素 它们的原子序数依次增大。其中A C原子的L层有
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子
A B C D为四种短周期元素 A原子核外仅有1个电子 B C元素的最高价依次+4 +5 D元素常显
A、B、C、D为四种短周期元素,A原子核外仅有1个电子,B、C元素的最高价依次+4、+5,D元素常显-2价,已知B、C、D的原子次外层电子数均为2。(1)按要求写
决定物质性质的重要因素是物质的结构。请回答下列问题:(1)N O S三种元素的第一电离能从大到小的顺
决定物质性质的重要因素是物质的结构。请回答下列问题:(1)N、O、S三种元素的第一电离能从大到小的顺序为 。(2)甲醛(H2C=O)分子碳原子的杂化方式为
某元素X的气态氢化物的化学式为H2X 则X的最高价氧化物的水化物的化学式为[ ]A.H2XO
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为[ ]A H2XO3B HXO3C H3XO4D H2XO4
【选修3物质结构与性质】(15分) VIA族的氧 硫 硒(Se) 碲(Te)等元素在化合物中常表现出
【选修3物质结构与性质】(15分) VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用












