我市有丰富的NaCl矿产资源 NaCl是一种重要的化工原料 可以用于生产烧碱 氯气等重要的化工产品。
| 我市有丰富的NaCl矿产资源,NaCl是一种重要的化工原料,可以用于生产烧碱、氯气等重要的化工产品。某化工厂购进一批以NaCl为主要成分的原料(假设杂质全部为CaCl2),化验员欲测定原料中NaCl的质量分数,先称取60.0g样品,加足量水充分溶解后,向所得溶液中加入足量的溶质质量分数为10%的Na2CO3溶液,充分反应后,生成2.0g白色沉淀。(已知:CaCl2+Na2CO3==2NaCl+CaCO3↓) 试回答下列问题(写出计算过程): (1)原料中NaCl的质量分数是多少? (2)当恰好完全反应时,需Na2CO3溶液的质量是多少? |
参考解答
| 解:设原料中CaCl2的质量为X,当恰好完全反应时,需Na2CO3溶液的质量为Y CaCl2+Na2CO3==2NaCl+CaCO3↓ 111 106 100 X Y×10% 2.0g (1) 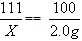 X=2.22g X=2.22g原料中NaCl的质量分数= 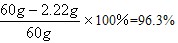 (2) 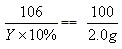 Y=21.2g |
相似问题
将14 g 含杂质的氯酸钾样品和2 g 二氧化锰混合后放入试管中加 热 充分反应后 停止加热 让试管
将14 g 含杂质的氯酸钾样品和2 g 二氧化锰混合后放入试管中加热,充分反应后,停止加热,让试管冷却,称得试管内剩余固体的质量 为11 2 g 。求:(
现有氯化钠和硝酸钾的固体混合物10.85g 将它们全部放入烧杯中 再加入170g硝酸银溶液恰好完全反
现有氯化钠和硝酸钾的固体混合物10 85g,将它们全部放入烧杯中,再加入170g硝酸银溶液恰好完全反应,然后过滤、洗涤、干燥,称得沉淀14 35g,则原固体混
今有未知溶质质量分数的盐酸50 g 与7.8 g 锌充分反应后 锌有剩余 然后再加入20 g7.3
今有未知溶质质量分数的盐酸50 g ,与7 8 g 锌充分反应后,锌有剩余,然后再加入20 g7 3% 的盐酸,恰好与剩余的锌完全反应,求:(1)第一次反应时
H2和O2的混合气体10g 点燃后充分反应生成9g水 则原混合气体中H2和O2的质量之比为_____
H2和O2的混合气体10g,点燃后充分反应生成9g水,则原混合气体中H2和O2的质量之比为_________。
某同学用过氧化氢溶液和二氧化锰制取氧气 化学方程式为:2H2O22H2O+O2↑ 该同学将50g过氧
某同学用过氧化氢溶液和二氧化锰制取氧气,化学方程式为:2H2O22H2O+O2↑,该同学将50g过氧化氢溶液和1g二氧化锰混合,完全反应后,称量剩余的混合物质量












