有一包固体粉末 可能是CaCO3 Na2SO4 CuSO4 Na2CO3中的一种或多种。为确定原固体
| 有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种。为确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH==Na2SO4+Cu(OH)2↓,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:(结果保留小数点后一位) |
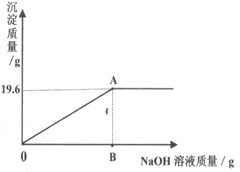 |
| (1)计算产生最大沉淀量时所加NaOH溶液的质量。 (2)通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量) (3)计算A点所示溶液中溶质的质量分数。 |
参考解答
| (1)解:设生成最大沉淀量时所加NaOH的质量为x;46.2g粉末中含有CuSO4的质量为y;生成Na2SO4的质量为z。 CuSO4+2NaOH===Na2SO4+Cu(OH)2↓ 160 80 142 98 y x z 19.6g 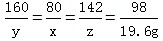 x=16.0g 那么NaOH溶液的质量 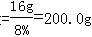 y=32.0g;z=28.4g (2)Na2SO4的质量=46.2g-32g=14.2g 则46.2g固体粉末由14.2gNa2SO4和32.0gCuSO4组成。 (3)Na2SO4的质量分数= 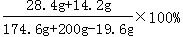 =12.0% =12.0% |
相似问题
氧化铜和木炭粉的混合物25克 加热一段时间后 冷却 称量剩余固体的质量是20.6克。被还原的氧化铜的
氧化铜和木炭粉的混合物25克,加热一段时间后,冷却,称量剩余固体的质量是20 6克。被还原的氧化铜的质量是 [ ]A.16克 B.4 4克 C.25克 D.12克
长久使用的热水瓶底部有一层水垢 主要成分是碳酸钙 用稀盐酸可以清除水垢。某学校化学课外兴趣小组的同学
长久使用的热水瓶底部有一层水垢,主要成分是碳酸钙,用稀盐酸可以清除水垢。某学校化学课外兴趣小组的同学通过实验测定水垢中碳酸钙的含量,将过量的稀
完全电解ag水 得到氢气10mL 同时可得到氧气的质量和体积分别为[ ]A.ag 10mLB
完全电解ag水,得到氢气10mL,同时可得到氧气的质量和体积分别为[ ]A.ag,10mLB.ag,5mLC.(16 9)ag,5mLD.(8 9)ag,5mL
有两种外观类似黄金的A.Cu-Zn合金和B.Cu-Ag合金 若实验室只提供一瓶稀硫酸和必要仪器。(1
有两种外观类似黄金的A Cu-Zn合金和B Cu-Ag合金,若实验室只提供一瓶稀硫酸和必要仪器。(1)你认为能测出合金____________(填序号)中铜的质量分数;(
CO是大气污染物之一。用氯化钯(PdCl2)可以测定微量CO的存在 该反应的化学方程式为PdCl2+
CO是大气污染物之一。用氯化钯(PdCl2)可以测定微量CO的存在,该反应的化学方程式为PdCl2+CO+H2O==Pd↓+2HCl+CO2。若反应后得到Pd的质量为1 06g,则测得CO












