工业上常回收冶炼锌废渣中的锌(含有ZnO FeO Fe2O3 CuO Al2O3等杂质) 并用来生产
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: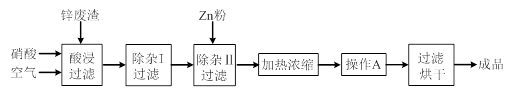 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。 (2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ 。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全。 (3)加入Zn粉的作用是除去溶液中的 。 |
参考解答
| (6分)(1)适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等) (2)Fe3+ 5.2 5.4 KSCN (3)Cu2+ |
试题分析:(1)根据外界条件对反应速率的影响可知,适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率。 (2)双氧水具有强氧化性,所以“除杂I”步骤中,需再加入适量H2O2溶液将亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4;又因为铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全。 (3)由流程图及离子沉淀的pH可知,滤液中还含有铜离子,所以加入Zn粉的作用除去溶液中的Cu2+。 |
相似问题
用下列实验装置完成对应的实验(部分仪器巳省略) 能达到实验目的的是A.干燥Cl2B.吸收HClC.液
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是A.干燥Cl2B.吸收HClC.液溴和苯的分馏D.吸收NH3
下列有关物质分离方法的叙述中 不正确的是 ( )。A.用过滤的方法分离溶液和胶体B.用蒸馏的
下列有关物质分离方法的叙述中,不正确的是 ( )。A.用过滤的方法分离溶液和胶体B.用蒸馏的方法将自来水制成蒸馏水C.用四氯化碳萃取碘水中的碘D.用
下列各组混合物中 能用分液漏斗进行分离的是A.苯和CCl4B.溴和CCl4C.酒精和水D.汽油和水
下列各组混合物中,能用分液漏斗进行分离的是A.苯和CCl4B.溴和CCl4C.酒精和水D.汽油和水
下列离子检验的方法正确的是A.某溶液有白色沉淀 说明原溶液中有Cl-B.某溶液有白色沉淀 说明原溶液
下列离子检验的方法正确的是A.某溶液有白色沉淀,说明原溶液中有Cl-B.某溶液有白色沉淀,说明原溶液中有SO42-C.某溶液有蓝色沉淀,说明原溶液中有Cu
某溶液含有Ⅲ中的离子(见下表) 欲用Ⅰ中的试剂来检验溶液是否还含有Ⅱ中的离子 能够成功检验的是(说明
某溶液含有Ⅲ中的离子(见下表),欲用Ⅰ中的试剂来检验溶液是否还含有Ⅱ中的离子,能够成功检验的是(说明:在实验过程中不允许加热、过滤、萃取等操作












