实验室用50mL0.50mol/L盐酸 50mL0.50mol/LNaOH溶液和如图所示装置进行测定
实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
(2)反应需要多次测量温度,每次测量温度后都必须采取的操作是______. (3)已知Q=cm△t,经数据处理,则该实验测得的中和热△H=______ (盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g?℃)计算). (4)盐酸与氢氧化钠的中和热的文献值为-57.3kJ/mol,你认为(3)中测得的实验值偏差可能的原因是______(至少说出两点) (5)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1______△H(填“<”、“>”或“=”),理由是______. 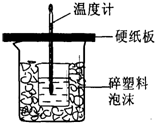 | ||||||||||||||||||
参考解答
| (1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,环形玻璃搅拌棒上下搅动使溶液充分反应;为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满; 故答案为:环形玻璃搅拌棒;上下搅动;应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满; (2)中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏低,但使测得的中和热偏高,所以每次测量后用水将温度计上的液体冲掉,并擦干温度计; 故答案为:用水将温度计上的液体冲掉,并擦干温度计 (3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:23.7℃=20.25℃=3.45℃; 第2次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应前后温度差为:23.8℃=20.4℃=3.4℃; 第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:24.9℃-21.55℃=3.35℃; 50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液,溶液质量m=100mL×1g/mL=100g,c=4.18J/(g?℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g?℃)×100g×
故答案为:-56.8 kJ/mol; (4)量热计的保温瓶绝热效果不好、酸碱溶液混合不迅速都会使温度偏低,测得的实验值产生偏差, 故答案为:①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速; (5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以△H1>△H, 故答案为:>;NH3?H2O电离吸热; |
相似问题
下列各组有机物只用一种试剂无法鉴别的是 [ ]A.乙醇 甲苯 硝基苯 B.苯 苯酚 己烯 C
下列各组有机物只用一种试剂无法鉴别的是 [ ]A.乙醇、甲苯、硝基苯 B.苯、苯酚、己烯 C.苯、甲苯、环己烷 D.甲酸、乙醛、乙酸
下列物质中 可一次性鉴别乙酸 乙醇 苯及氢氧化钡溶液的是[ ]A.金属钠 B.溴水 C.氯化
下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是[ ]A.金属钠 B.溴水 C.氯化钠溶液D.石蕊试液
50 mL 0.50 mol·L-1盐酸与 50 mL0. 55 mol·L-1 NaOH溶液在如图
50 mL 0 50 mol·L-1盐酸与 50 mL0 55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热,回答下
下列实验方法合理的是 [ ]A.用一种试剂能鉴别己烷 四氯化碳 乙醇三种无色液体 B.除去乙
下列实验方法合理的是 [ ]A.用一种试剂能鉴别己烷、四氯化碳、乙醇三种无色液体 B.除去乙醇中乙酸的方法:加入NaOH溶液,分液C.检验CH2=CH-CH2CHO
用洁净的铂丝蘸取溶液在酒精灯的外焰上灼烧 未看见火焰显紫色 溶液里一定不含K+.______(判断对
用洁净的铂丝蘸取溶液在酒精灯的外焰上灼烧,未看见火焰显紫色,溶液里一定不含K+.______(判断对错)正确的打“√”,错误的打“×”












