室温下 向含有0.10mol.L—1Mn2+和0.10mol.L—1Zn2+的混合溶液中 通入H2S
室温下,向含有0.10mol.L—1Mn2+和0.10mol.L—1Zn2+的混合溶液中,通入H2S气体维持饱和(H2S饱和溶液浓度为0.10mol.L—1),并用HCl控制溶液pH为2.00。有无沉淀生成?是什么沉淀?[KspΘ(MnS)=4.65×10—14,KspΘ(ZnS)=2.93×10—25,氢硫酸Ka1Θ=9.0×10—8,Ka2Θ=1.1×10—12]
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案: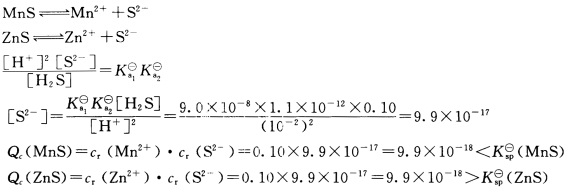 有沉淀生成生成的沉淀是ZnS。
有沉淀生成生成的沉淀是ZnS。
解题的关键是求出构晶离子浓度进而求算出离子积,利用溶度积规则即可判断沉淀生成与否。本题构晶离子S2—为弱碱,其浓度受溶液pH影响较大,可利用酸碱平衡有关知识求解。
相似问题
用自由能变判断反应的方向和限度时 必须在________条件下 该条件下 当△rGm>0时 反应将_
用自由能变判断反应的方向和限度时,必须在________条件下,该条件下,当△rGm>0时,反应将________进行。请帮忙给出正确答案和分析,谢谢!
若某—反应的△rHm和△rSm均为正值 当温度升高时 △rGm________。请帮忙给出正确答案和
若某—反应的△rHm和△rSm均为正值,当温度升高时,△rGm________。请帮忙给出正确答案和分析,谢谢!
欲使CaCO2在水溶液中溶解度增大 可以采用的办法是( )。A.加入1.0mol.L—1Na2CO3
欲使CaCO2在水溶液中溶解度增大,可以采用的办法是( )。A.加入1.0mol.L—1Na2CO3B.加入2.0mol.L—1NaOHC.加入0.10mol.L—1CaCl2D.降低溶液的p
对于电对Zn2+/Zn 增大Zn2+的浓度 则其标准电极电势值将( )。A.增大B.减小C.不变D.
对于电对Zn2+/Zn,增大Zn2+的浓度,则其标准电极电势值将( )。A.增大B.减小C.不变D.无法判断请帮忙给出正确答案和分析,谢谢!
在含有0.001mol.L—1Fe3+和0.10mol.L—1NH3的溶液中 需维持多大的NH4+离
在含有0.001mol.L—1Fe3+和0.10mol.L—1NH3的溶液中,需维持多大的NH4+离子的浓度才能阻止Fe(OH)3生成?这可以办到吗? {已知KspΘ[Fe(OH)3]=2.8×10












