计算在1 mol.L-1HCI溶液中 用Fe3+滴定Sn2+时 化学计量点的电势 并计算滴定至99.
计算在1 mol.L-1HCI溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(Eθ’(Fe3+/Fe2+)=0.68V;Eθ’(Sn4+/Sn2+)=0.14 V)
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:滴定反应为2Fe3++Sn2+===2Fe2++Sn4+ 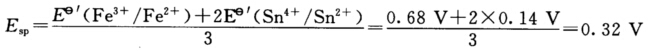 滴定至99.9%时:
滴定至99.9%时: 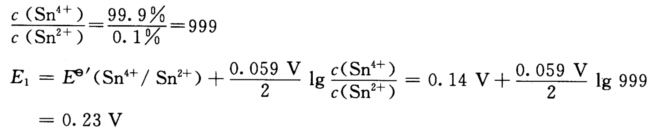 △E2=Esp—E1=0.32 V—0.23 V=0.09 V 滴定至100.1%时:
△E2=Esp—E1=0.32 V—0.23 V=0.09 V 滴定至100.1%时: 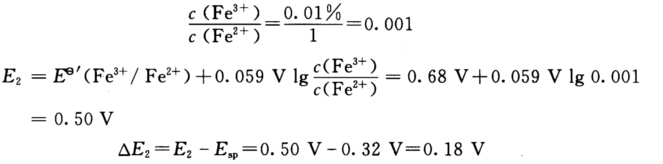 因此△E1≠△E2这是由于两电对电子转移数不相等所以计量点前后同样改变0.1%电势变化不相同。 电位滴定是以滴定曲线中突跃部分的中点作为滴定终点所以若用电位滴定判断终点将与化学计量点不一致。
因此△E1≠△E2这是由于两电对电子转移数不相等所以计量点前后同样改变0.1%电势变化不相同。 电位滴定是以滴定曲线中突跃部分的中点作为滴定终点所以若用电位滴定判断终点将与化学计量点不一致。
滴定反应为2Fe3++Sn2+===2Fe2++Sn4+滴定至99.9%时:△E2=Esp—E1=0.32V—0.23V=0.09V滴定至100.1%时:因此△E1≠△E2,这是由于两电对电子转移数不相等,所以计量点前后同样改变0.1%,电势变化不相同。电位滴定是以滴定曲线中突跃部分的中点作为滴定终点,所以若用电位滴定判断终点,将与化学计量点不一致。
相似问题
已知 Co(OH)3+e-/sup>===Co(OH)2+OH- Eθ=0.17 V Co3++e-
已知 Co(OH)3+e- sup>===Co(OH)2+OH- Eθ=0.17 V Co3++e-===Co2+ Eθ=1.82 V 试判断Co(OH)3的KSPθ和Co(OH)2的KSPθ哪个大?简述理由。请帮忙给出正确答案和分析,谢谢!
在含有Fe3+和Fe2+的溶液中 加入下述何种溶液 Fe3/Fe2+电对的电势将降低(不考虑离子强度
在含有Fe3+和Fe2+的溶液中,加入下述何种溶液,Fe3/Fe2+电对的电势将降低(不考虑离子强度的影响) ( )A.邻二氮菲B.HClC.H3PO4D.H2SO4请帮忙给出正
在Fe3++-e-===Fe2+ 电极反应中 加入Fe3+的络合剂F- 将使电极电势________
在Fe3++-e-===Fe2+ 电极反应中,加入Fe3+的络合剂F-,将使电极电势________________;在Cu2++e-===Cu+ 电极反应中,加入Cu+的沉淀剂I-,将使电极电势__
下列化合物中 具有磁性的是 ( )A.Na2O2B.SrOC.KO2D.BaO2请帮忙给出正确答案和
下列化合物中,具有磁性的是 ( )A.Na2O2B.SrOC.KO2D.BaO2请帮忙给出正确答案和分析,谢谢!
测定软锰矿中的MnO2含量时 在HCl溶液中MnO2能氧化I-析出I2 可以用碘量法测定MnO2的含
测定软锰矿中的MnO2含量时,在HCl溶液中MnO2能氧化I-析出I2,可以用碘量法测定MnO2的含量,但Fe3+有干扰。实验说明,用磷酸代替HCI时,Fe3+无干扰,何故?












