氮化铝(AlN)具有耐高温 抗冲击 导热性好等优良性质 被广泛应用于电子工业 陶瓷工业等领域。在一定
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C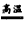 2AlN+3CO,下列叙述正确的是 2AlN+3CO,下列叙述正确的是 |
| [ ] |
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 B.上述反应中每生成2 molAlN,N2得到3mol电子 C.氮化铝中氮元素的化合价为-3价 D.氮化铝晶体既是氧化剂又是还原剂 |
参考解答
| C |
相似问题
1962年 英国化学家将PtF6和稀有气体单质氙(Xe)适量混合后 首次制得稀有气体化合物六氟合铂酸
1962年,英国化学家将PtF6和稀有气体单质氙(Xe)适量混合后,首次制得稀有气体化合物六氟合铂酸 氙,发生反应的化学方程式可表示为:Xe+PtF6→XePtF6。下
在反应2KMnO4K2MnO4 + MnO2 + O2↑中 得电子的原子和失电子的原子的个数比是[
在反应2KMnO4K2MnO4 + MnO2 + O2↑中,得电子的原子和失电子的原子的个数比是[ ]A.4:1B.1:4 C.1:1 D.2:1
从海水中可以提取溴 主要反应为:2Br-+Cl2 = 2Br2+2Cl- 下列说法正确的是[
从海水中可以提取溴,主要反应为:2Br-+Cl2 = 2Br2+2Cl-,下列说法正确的是[ ]A.溴离子具有氧化性 B.氯气做还原剂 C.该反应属于复分解反应 D.
工业上制造高温结构陶瓷碳化硅(SiC)的化学方程式如下:SiO2+3CSiC+2CO↑。在这个氧化还
工业上制造高温结构陶瓷碳化硅(SiC)的化学方程式如下:SiO2+3CSiC+2CO↑。在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是[ ]A.1:2 B.2:1 C.1:1 D.3:5
被称为万能还原剂的NaBH4 溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑下列说法正
被称为万能还原剂的NaBH4,溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑下列说法正确的是[ ]A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,水是还












