(4分)完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □
| (4分)完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □ , 该反应中氧化剂是 ,当生成2mol NO时,转移的电子数为 NA。 |
参考解答
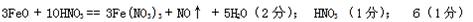 |
| 略 |
相似问题
某金属单质与一定浓度的HNO3反应 假定只有单一的还原产物 当参加反应的单质与被还原的HNO3物质的
某金属单质与一定浓度的HNO3反应,假定只有单一的还原产物,当参加反应的单质与被还原的HNO3物质的量之比为3:2时,还原产物A.NO2 B.NO C.N2O D.N2
下列说法不正确的是A.金属单质与盐溶液的反应都是置换反应B.4Fe(OH)2+O2+2H2O=4Fe
下列说法不正确的是A.金属单质与盐溶液的反应都是置换反应B.4Fe(OH)2+O2+2H2O=4Fe(OH)3属于化合反应C.SO2+Cl2+2H2O=2HCl+H2SO4属于氧化还原反应D
已知M2O2-n离子可与R2-离子作用 R2-被氧化为R单质 在M2O2-n的还原产物中 M为+3价
已知M2O2-n离子可与R2-离子作用,R2-被氧化为R单质,在M2O2-n的还原产物中,M为+3价;又如c(M2O2-3)=0 3mol·L-1的溶液100mL可与c(R2-)=0 6mol·L-1的溶
已知硫化亚铜与一定浓度的硝酸共热 所得溶液中只有硝酸铜和硫酸铜 放出一氧化氮和二氧化氮两种气体 且两
已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:①MnO2 + H2O2 +
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O②Mn2+ + H2O2 = MnO2












