实验室可用如下反应制取氯气 反应原理如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2
| 实验室可用如下反应制取氯气,反应原理如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O (1)用单线桥表示出上述反应中电子转移的方向和数目 (2)上述反应中氧化剂与还原剂的物质的量比______ (3)15.8g KMnO4能使多少克HCl被氧化? (4)产生的Cl2在标准状况下的体积为多少? |
参考解答
| (1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为: , 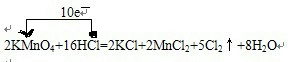 故答案为: 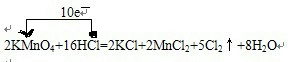 ; (2)反应中,化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,16mol的盐酸中只有10mol做还原剂,化合价降低元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比 1:5,故答案为:1:5; (3)设15.8g KMnO4能氧化盐酸的质量是x,则根据方程式2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,可得高锰酸钾和被氧化的盐酸的量之间的关系为:2KMnO4~10HCl,所以 2KMnO4~10HCl 2×158 365 15.8g x 则
解得x=18.25g 答:15.8g KMnO4能使18.25克HCl被氧化. (4)设15.8g即0.1molKMnO4氧化盐酸产生的Cl2的物质的量是n, 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O, 2 5 0.1mol n
解得n=0.25mol,体积为:0.25mol×22.4L/mol=5.6L. 答:产生的Cl2在标准状况下的体积为5.6L. |
相似问题
下列反应既属于离子反应 又属于还原反应的是( )A.NaCl溶液+AgNO3溶液B.Na+Cl2C
下列反应既属于离子反应,又属于还原反应的是( )A.NaCl溶液+AgNO3溶液B.Na+Cl2C.CO+Fe2O3D.Zn+稀(H2SO4)
实现下列反应需加入氧化剂的是( )A.NaOH→NaClB.H2SO4→H2C.HCl→Cl2D.
实现下列反应需加入氧化剂的是( )A.NaOH→NaClB.H2SO4→H2C.HCl→Cl2D.CaCO3→CO2
下列属于氧化还原反应的是( )A.CO2+H2O=H2CO3B.H2CO3=CO2↑+H2OC.2
下列属于氧化还原反应的是( )A.CO2+H2O=H2CO3B.H2CO3=CO2↑+H2OC.2NaOH+H2SO4=Na2SO4+2H2OD.C+O2点燃 CO2
下列反应中 不属于氧化还原反应的是( )A.2CO+O2 点燃 . 2CO2B.CH4+2O2 点
下列反应中,不属于氧化还原反应的是( )A.2CO+O2点燃 2CO2B.CH4+2O2点燃 CO2+2H2OC.2KClOMnO2 △2KCl+3O2↑D.2Fe(OH)3△ Fe2O3+3H2O
下列物质间的转化 需要加入氧化剂才能实现的是( )A.Fe2O3→FeB.KClO3→KClC.N
下列物质间的转化,需要加入氧化剂才能实现的是( )A.Fe2O3→FeB.KClO3→KClC.NH3→NOD.H2SO4(浓)→SO2












