实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气 反应的化学方程式为:MnO2+4HCl(浓)MnC
| 实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为: MnO2+4HCl(浓) 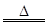 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O(1)反应物中,氧化剂是________;化合价升高的元素是________。 (2)取一定体积的浓盐酸与MnO2发生反应,产生的氯气在标准状况下的体积为1.12 L(忽略Cl2的溶解)。则参加反应的HCl的物质的量是________;反应中被氧化的HCl的质量是________。(写出简要解题过程) |
参考解答
| (1)二氧化锰 ;氯元素 (2)0.2mol;3.65g |
试题分析:(1)氧化剂是二氧化锰,化合价升高的元素是氯元素; (2)假设参加反应的HCl的物质的量是xmol MnO2+4HCl(浓) 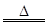 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O4mol 22.4L xmol 1.12L 解之得:x=0.2mol 其中被氧化的HCl正好是一半,质量为:3.65g |
相似问题
LiAlH4是重要的储氢材料 其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2L
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH42LiH+2Al+3H2↑②LiAlH4+2H2O=LiAlO2+4H2↑下列说法
FeS2可在Fe2(SO4)3溶液中“溶解” 硫元素都以SO42-的形式存在。若有l mol FeS
FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-的形式存在。若有l mol FeS2“溶解”,则生成H2SO4的物质的量为A.2molB.4 molC.6 molD.8 mol
PbO2是褐色固体 受热分解为Pb的+4和+2+4价的混合氧化物 +4价的Pb能氧化浓盐酸生成Cl
PbO2是褐色固体,受热分解为Pb的+4和+2+4价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐
氮化硅(Si3N4)是一种新型陶瓷材料 它可由石英与焦炭在高温的氮气流中 通过以下反应制得:3SiO
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2Si3N4+6CO。下列叙述正确的是A.Si3N4的摩尔质
将18 g铜和铁的混合物投入200 mL稀硝酸中 充分反应后得到标准状况下2.24 L NO 剩
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2 24 L NO,剩余9 6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又












