磷是地壳中含量较为丰富的非金属元素 主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和
| 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。 (1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下: 2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1 CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1 2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3 则ΔH3=________kJ·mol-1。 (2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 60 mol CuSO4能氧化白磷的物质的量是________。 (3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。 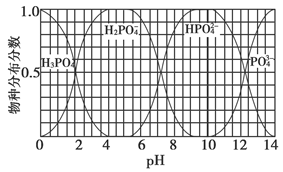 ①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。 ②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。 (4)磷的化合物三氯氧磷( 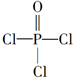 )与季戊四醇( )与季戊四醇(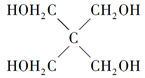 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: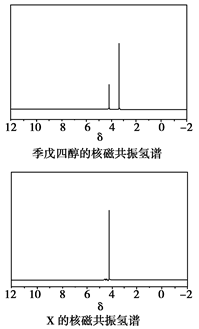 ①酸性气体是______________________(填化学式)。 ②X的结构简式为__________________。 |
参考解答
| (1)2821.6 (2)3 mol (3)①4~5.5(介于此区间内的任意值或区间均可) c(HPO42—)>c(H2PO4—) ②3Ca2++2HPO42—=Ca3(PO4)2↓+2H+ (4)①HCl 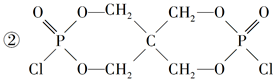 |
| 应用化学反应原理分析相关问题,得出合理答案。 (1)2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH=+3359.26 kJ·mol-1① CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-89.61 kJ·mol-1②根据盖斯定律,①+②×6得ΔH3=+2821.6 kJ·mol-1。 (2)该反应中,Cu2+转化为Cu+,则60 mol CuSO4转移60 mol e-, 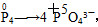 ,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。 ,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。(3)根据图像可知获得纯净的NaH2PO4应控制pH在4~5.5之间。pH=8时溶质主要是Na2HPO4和NaH2PO4。此时c(HPO42—)>c(H2PO4—)。加入CaCl2后,Ca2+结合HPO42—电离出的PO42—生成沉淀,促进了HPO42—的电离,反应的离子方程式为3Ca3++2HPO42—=Ca3(PO4)2↓+2H+。 (4)根据元素种类可以判定酸性气体是HCl,根据元素守恒及反应物季戊四醇的核磁共振氢谱、生成物X的核磁共振氢谱推出反应为 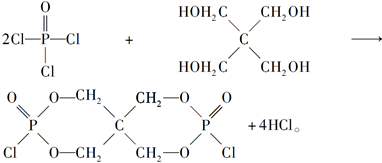 点拨:知识:反应热计算、氧化还原反应、离子浓度大小比较、离子方程式等。能力:考查学生对化学知识综合运用、解决问题的能力。试题难度:较大。 |
相似问题
下列说法正确的是( )A.常温常压下 22.4 L氯气与足量镁粉充分反应 转移的电子数为2NAB.
下列说法正确的是( )A.常温常压下,22 4 L氯气与足量镁粉充分反应,转移的电子数为2NAB.化合反应均为氧化还原反应C.电解NaCl溶液得到22 4 L H2(
(10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL 质量分数为63.0%的浓
(10分)将1 52g铜镁合金完全溶解于50 0mL密度为1 40g mL、质量分数为63 0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入
锌与很稀的硝酸反应生成硝酸锌 硝酸铵和水。当生成1 mol硝酸锌时 被还原的硝酸的物质的量为 (
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为 ( )。A.2 mol B.1 mol C.0 5 mol D.0 25 mol
黑火药是中国的“四大发明”之一 黑火药在发生爆炸时 发生如下的反应:2KNO3+3C+S═K2S+N
黑火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S═K2S+N2↑+3CO2↑.其中被还原的元素是______,还原剂是______.若有
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是 ( )。A.S2O32-是还原剂B.Y的化学












