Ⅰ.用MnO2氧化密度为1.19 g·cm-3 溶质质量分数为36.5%的HCl溶液。反应的化学方程
Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: 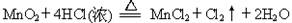 (1)该盐酸的物质的量浓度为 mol/L。 (2)用双线桥法表示出该反应的电子转移方向和数目 。 (3)8.7gMnO2能使 molHCl被氧化。 Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原 的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。 |
参考解答
| Ⅰ(1)11.9 (2)  (3)0.2 Ⅱ 大于 3Cu+8H++2NO3-=3Cu2++2NO +4H2O |
试题分析:Ⅰ.(1)有公式c='1000pw/M=1000×1.19×36.5%/36.5=11.9' mol/L; (2) 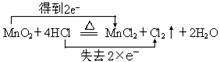 (3)在反应中MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O1mol MnO2氧化2mol浓盐酸,所以8.7gMnO2能使0.2molHCl被氧化. Ⅱ.已知反应 Cu+2H2SO4  CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9='1.8(mol)' CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9='1.8(mol)' 又知,硫酸的物质的量浓度为18mol/L ;所以原体积为1.8/18=0.1L;参加反应H2SO4为0.9mol×2=1.8mol,体积100mL,因反应后稀H2SO4不与Cu反应,故H2SO4体积应大于100mL。加入硝酸盐后,相当于铜与稀硝酸反应,3Cu+8H++2NO3-=3Cu2++2NO +4H2O |
相似问题
将69 g NO2(含少量N2O4)通入水中 关于此过程下列说法正确的是(NA表示阿伏加德罗常数)A
将69 g NO2(含少量N2O4)通入水中,关于此过程下列说法正确的是(NA表示阿伏加德罗常数)A.69 g NO2与N2O4混合气体所含原子数介于4 5 NA至9 0 NA
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 有关该反应
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:()A.被氧化的元素和被还原的元素的质量之比5:1B.Cl2既
金属冶炼与处理常涉及氧化还原反应。(1)由下列物质冶炼相应金属时采用电解法的是________。a.
金属冶炼与处理常涉及氧化还原反应。(1)由下列物质冶炼相应金属时采用电解法的是________。a Fe2O3 b.NaCl c.Cu2S d.Al2O3(2)辉铜矿(Cu2S)可发生
判断给定化学反应是否为氧化还原反应的依据是[ ]A.看反应前后是否有氧原子的得失 B.看反应
判断给定化学反应是否为氧化还原反应的依据是[ ]A.看反应前后是否有氧原子的得失 B.看反应前后是否有原子的重新组合 C.看反应前后是否有电子的得失
将51.2 g Cu完全溶于适量浓硝酸中 收集到氮的氧化物(含NO N2O4 NO2)的混合物 这些
将51 2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被500 mL 2 0 mol L NaOH溶液完全吸收,生成含NaNO












