磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为) 三聚磷酸钠(
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为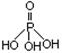 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。完成下列填空: (1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。 (2)氧原子核外有 种不同能量的电子。 (3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。 (4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。 (5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。 (6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。 |
参考解答
| (1)3S23P3; H<O<P<Na (2)3 (3)H+ + AlO2- + H2O  Al(OH)3 Al(OH)3 Al3+ + 3OH- (2分) Al3+ + 3OH- (2分)(4)磷酸二氢根离子电离程度大于水解程度 (2分) (5) 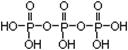 ; Na5P3O10 ; Na5P3O10(6)Ni2++H2PO2-+H2O→ Ni+H2PO3-+2H+ (2分) Ni |
试题分析:(1)H原子有1个电子层,O有2个电子层,P和Na有3个电子层且Na质子数少半径大,故半径大小顺序为H<O<P<Na; (2)氧原子电子排布式为1S22S22P4,同轨道电子能量相同,故3种不同能量的电子; (3)H2PO2-为弱酸跟离子,在溶液中既能水解又能电离,水溶液呈酸性的原因说明其电离程度大于水解程度,以电离为主; (4)磷酸分子间脱水应是两个羟基的脱水反应;三聚磷酸钠(俗称“五钠”)即是三聚磷酸中羟基氢被钠取代的产物; (6)根据氧化还原反应电子守恒配平,氧化剂Ni2+生成还原产物Ni。 |
相似问题
Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水 近年来倍受人们的青睐 被称为“绿色氧化剂”。⑴写出H2O
Ⅰ 过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。⑴写出H2O2的电子式_________________,其分子内存在______键和___
氰化物有剧毒 我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L;对废水中CN-的处
氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0 5 mg L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和C
已知实验室中 可用Co2O3代替MnO2来制备氯气 反应前后存在的六种微粒分别是:Co2O3 H2O
已知实验室中,可用Co2O3代替MnO2来制备氯气,反应前后存在的六种微粒分别是:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是A.Cl2发生还原反应B
(12分)一个体重50kg的健康人 体内约含有2g铁 这2g铁在人体内不是以单质的形式存在 而是以F
(12分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补
向CuSO4溶液中逐滴加入KI溶液至过量 观察到产生白色沉淀CuI 溶液变为棕色。再向反应后的混合物
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确












