(8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。(1)过碳酸钠是一种有多种用途的新
| (8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。 (1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。 ①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________, ②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。 (2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题: 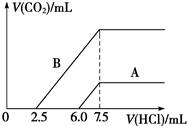 ①_______曲线正确,天然碱的化学式为___________, ③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。 (3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。 亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。 |
参考解答
| (1)①NaHCO3 (1分) ②2MnO+5H2O2+6H+===2Mn2++8H2O+5O2↑(2分) (2)B; (1分) Na2CO3·NaHCO3·2H2O,(1分) 112(1分) (3)6.02×1023(1分) |
| (1)①根据原子守恒可知A应该是碳酸氢钠。 ②H2O2→ O2,说明双氧水是还原剂,所以MnO4-是氧化剂,则方程式为2MnO+5H2O2+6H+===2Mn2++8H2O+5O2↑。 (2)由于碳酸钠和盐酸反应是分步进行的,即Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。因此在含有碳酸氢钠的条件下,生成CO2时消耗的盐酸多,即B曲线正确;根据图像可知,和碳酸钠反应的盐酸时2.5ml,所以和原碳酸氢钠反应的盐酸是7.5ml-2.5ml-2.5ml=2.5ml,因此a和b的比值是1︰1的,则化学式为Na2CO3·NaHCO3·2H2O;根据图像可知生成CO2时消耗的盐酸是5ml,所以生成CO2是0.005mol,标准状况下的体积是0.112L。 (3)HClO2中氯元素的化合价是+3价,反应后部分升高到+4价,所以当有1 mol ClO2生成时转移的电子是1mol,个数是6.02×1023。 |
相似问题
(7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-
(7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-→NO+2H2OKMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一
(8分)在 2Na2O2+2CO2===2Na2CO3+O2反应中 (1)请在此方程上用双线桥法标出
(8分)在 2Na2O2+2CO2===2Na2CO3+O2反应中,(1)请在此方程上用双线桥法标出电子转移的方向和数目。(2)是还原剂,是氧化剂。(3)若转移3mol电子,
在淀粉-KI溶液中滴入少量NaClO溶液 并加入少量硫酸 溶液立即变蓝 这是因为⑴_________
在淀粉-KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,这是因为⑴___________________________,离子方程式:___________________________
某含Cr2O72- 的含铬废水用硫亚铁铵[(NH4)2 SO4·FeSO4·6H2O]处理 反应中铁
某含Cr2O72- 的含铬废水用硫亚铁铵[(NH4)2 SO4·FeSO4·6H2O]处理,反应中铁元素和铬元素(+3价)完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrx
虽然氟元素早在1810年就被发现 但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F












